
Рефераты по международному публичному праву
Рефераты по международному частному праву
Рефераты по международным отношениям
Рефераты по культуре и искусству
Рефераты по менеджменту
Рефераты по металлургии
Рефераты по муниципальному праву
Рефераты по налогообложению
Рефераты по оккультизму и уфологии
Рефераты по педагогике
Рефераты по политологии
Рефераты по праву
Биографии
Рефераты по предпринимательству
Рефераты по психологии
Рефераты по радиоэлектронике
Рефераты по риторике
Рефераты по социологии
Рефераты по статистике
Рефераты по страхованию
Рефераты по строительству
Рефераты по таможенной системе
Сочинения по литературе и русскому языку
Рефераты по теории государства и права
Рефераты по теории организации
Рефераты по теплотехнике
Рефераты по технологии
Рефераты по товароведению
Рефераты по транспорту
Рефераты по трудовому праву
Рефераты по туризму
Рефераты по уголовному праву и процессу
Рефераты по управлению
Реферат: Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
Реферат: Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
Вступ
Тема реферату «Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів» з дисципліни «Загальна хімічна технологія».
Мета роботи – ознайомлення з:
- класифікацією хіміко-технологічних процесів (ХТП);
- фізико-хімічними основами керування ефективністю процесів;
- термодинамічними аспектами (рівновагою). Впливом на рівновагу технологічних параметрів процесу;
- кінетикою процесів. Впливом технологічних параметрів на швидкість хімічних реакцій;
- швидкістю гетерогенних ХТП;
- кінетичними моделями гетерогенних процесів в системі «Г-Т». Моделлю з фронтальним переміщенням зони реакції
- гетерогенними процесами в системі газ-рідина.
Хіміко-технологічний процес (ХТП) – сукупність операцій, які дозволяють одержати цільовий продукт з вихідної сировини. Найважливішим етапом ХТП є хімічна реакція.
1. Хіміко-технологічні процеси - складова хімічного виробництва
1.1 Класифікація хімічних реакцій, на яких засновані ХТП
В залежності від фазового складу розрізняють гомогенні та гетерогенні хімічні реакції. У випадку гомогенних хімічних реакцій реагенти знаходяться в одній фазі – рідині або газу.
Приклад гомогенної хімічної реакції:
- у газовій фазі окиснення оксиду азоту у виробництві слабкої азотної кислоти
![]()
- у рідинній фазі – реакції етерифікації.
В гетерогенних реакціях реагенти і продукти реакції повинні знаходитись хоча б у двох фазах. Існують наступні системи: «газ-рідина», «газ-тверде», «рідина-тверде», «рідина-рідина», «тверде-тверде», а також різні варіанти трьохфазних систем.
За механізмом розрізняють прості (одно стадійні) та складні (багатостадійні) реакції, які в свою чергу розподіляють на паралельні, послідовні, та паралельно-послідовні.
По молекулярності (за кількістю молекул, які приймають участь в елементарному процесі) виділяють моно-, бі-, та тримолекулярні реакції.
За використанням каталізаторів розрізняють каталітичні та некаталітичні реакції.
За тепловим
ефектом розрізняють екзотермічні (з виділенням тепла![]() ) та ендотермічні (з поглинанням
тепла
) та ендотермічні (з поглинанням
тепла![]() ).
).
1.2 Фізико-хімічні закономірності хіміко-технологічних процесів
Фізико-хімічні закономірності ХТП підрозділяють на термодинамічні та кінетичні.
На основі законів термодинаміки проводять розрахунки рівноваги хіміко-технологічних процесів. За звичай розраховують рівноважний ступінь перетворення, визначають методи зміщення рівноваги хімічних реакцій в найбільш вигідний для ХТП бік.
На основі кінетичних закономірностей визначають швидкість хімічних реакцій в різних умовах та залежність швидкості від технологічних параметрів процесу (температури, тиску, співвідношення реагентів, їх концентрації та ін.)
Регулюючи рівновагу та швидкість ХТП досягають бажаних або максимально можливих показників ефективності – продуктивності, ступеня перетворення сировини, мінімальних витратних коефіцієнтів сировини.
1.3 Рівновага в хіміко-технологічних процесах
Розрізняють зворотні та незворотні хіміко-технологічні процеси. Всі зворотні процеси прямують до рівноваги, стану в якому швидкість прямої та зворотної реакції однакові, в результаті чого співвідношення компонентів в реакційній суміші лишається незмінним до того часу поки не зміняться технологічні параметри процесу. В разі зміни температури, тиску, концентрації реагентів рівновага порушується і процес може протікати в тому чи іншому напрямку до встановлення повної рівноваги.
Система, що знаходиться в стані рівноваги характеризується наступними ознаками:
1)швидкості прямої та зворотної реакцій повинні бути однакові;
2)в системі не повинно виникати ні яких видимих змін;
3)система повинна бути ізольованою.
Кількісно стан рівноваги описується законом діючих мас:
При постійній температурі та наявності рівноваги відношення множення діючих мас продуктів реакції до діючих мас реагентів є величина постійна – константа рівноваги. Константу рівноваги можна розрахувати з визначення стану рівноваги, як рівність швидкостей прямої та зворотної реакцій.
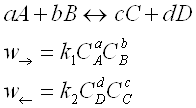
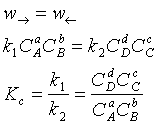
У випадку аналізу реакцій, які протікають в газовій фазі, константу рівновагі виражають через порційні тиски.
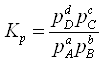
Розрахунки
константи рівноваги проводять через значення ізобарно-ізотермічного-потенціалу ![]() , згідно з
рівнянням ізобари хімічної реакції:
, згідно з
рівнянням ізобари хімічної реакції:
![]()
![]() ,
,
де ![]() - відповідно
значення ентальпії та ентропії хімічної реакції, які розраховують за даними
довідкових таблиць термодинамічних величин.
- відповідно
значення ентальпії та ентропії хімічної реакції, які розраховують за даними
довідкових таблиць термодинамічних величин.
Величина константи рівноваги вказує на ступінь завершеності хімічної реакції.
На при кінці 19-го сторіччя Анрі Ле Шател’є в короткому повідомленні на засіданні паризької академії наук сформулював свій славнозвісний принцип:
В системі, яку виведено зі стану рівноваги в результаті зовнішній дії, самотужки протікають зміни, що зменшують ці дії.
реакція хімічний реагент концентрація
1.4 Вплив умов протікання реакції на стан рівноваги
Якщо константа рівноваги велика, то концентрації продуктів великі у порівнянні з концентраціями реагентів. У такому випадку кажуть, що рівновагу зсунуто вправо, якщо константа рівноваги невелика, то рівновагу зсунуто вліво.
Якщо в рівноважній системі провести зміну концентрації, рівноважний склад суміші зміниться. Оскільки константа рівноваги величина постійна для даної температури (співвідношення діючих мас реагентів і продуктів), то збільшення концентрації реагентів призведе до збільшення концентрації продуктів та навпаки.
Вплив тиску на рівновагу системи, в який не має газів зовсім малий. Зміна тиску рівноважної суміші газів, не впливає на константу рівноваги та впливає на стан рівноваги. Наприклад, для процесу:
![]()
Константу рівноваги розраховують за рівнянням:
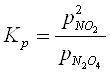 ,
,
порційні тиски компонентів реакційної суміші можна виразити через мольні частки компонентів та загальний тиск в системі Р.
![]() ,
,
![]() ,
,
тоді константу рівноваги можна розрахувати:
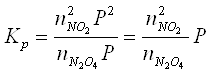
Т. ч., якщо
загальний тиск в системі зростає, співвідношення  буде зменшуватися – рівновагу
буде зсунуто вліво. Та навпаки зі зменшенням тиску це співвідношення буде
зростати.
буде зменшуватися – рівновагу
буде зсунуто вліво. Та навпаки зі зменшенням тиску це співвідношення буде
зростати.
Вплив
температури. Зміна температури змінює значення константи рівноваги відповідно
до рівняння ізобари. Якщо ![]() (ендотермічна реакція) при
збільшенні температури константа рівноваги збільшується. Якщо
(ендотермічна реакція) при
збільшенні температури константа рівноваги збільшується. Якщо ![]() (екзотермічна реакція)
при збільшенні температури константа рівноваги зменшується.
(екзотермічна реакція)
при збільшенні температури константа рівноваги зменшується.
1.6 Кінетичні закономірності ХТП
Розрахунки рівноваги дозволяють визначити тільки максимально можливий ступінь перетворення компонентів сировини. Але, в умовах виробництва, які обмежені часом цей граничний ступінь перетворення не досягається із-за того, що знижується концентрація реагентів і як слідство – швидкість хімічних реакцій.
Рівняння, які описують залежність швидкості хімічної реакції від концентрації, називають кінетичними (кінетичними моделями), їх одержують в результаті кінетичних досліджень. Кінетичні моделі є основою математичної моделі хімічного реактору, їх використовують для вибору типу та розрахунку конструктивних розмірів реактору.
1.7 Швидкість гомогенних хімічних реакцій
Швидкістю хімічної реакції називають кількість молей одного з реагентів (продуктів), що реагують (або утворюються) в одиницю часу в одиниці реакційного простору (об’єму реактору).
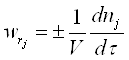 ,
,
де V – об’єм реактору;
dnj - зміна кількості молей реагенту ;
dτ – незначний проміжок часу.
Так як ![]()
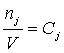 , тоді швидкість реакції
можна виразити через концентрацію реагенту:
, тоді швидкість реакції
можна виразити через концентрацію реагенту:
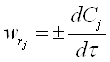 ,
,
Знак перед похідною вказує на напрям змінення концентрації, якщо це швидкість визначається за реагентом, він витрачається, концентрація зменшується (-), якщо швидкість було визначено за продуктом, то він утворюється, його концентрація росте (+).
Якщо реакція описується рівнянням:
![]() ,
,
то зміни кількості молей речовин-учасників реакції пов’язані між собою наступним співвідношенням:
![]() .
.
Таким чином числові значення швидкостей реакції розраховані за різними реагентами мають відрізнятися одне від одного, та проте пов’язані між собою співвідношенням:
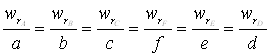
Для приведення швидкості до єдиного виду, такому, що б можна було судити про її зміну по будь-якому компоненту, використовують рівняння швидкості в такій формі:
![]() ,
,
де j – стехіометричний коефіцієнт.
1.8 Залежність швидкості хімічних реакцій від концентрації реагентів
Фактори, які впливають на швидкість хімічних реакцій поділяють на дві групи:
- чисто кінетичні (мікрокінетичні) – визначають швидкість взаємодії на молекулярному рівні;
- макрокінетичні, які визначають вплив на швидкість транспорту реагентів до зони реакції, наявність або відсутність перемішування та геометричних розмірів реактору.
Швидкість гомогенної реакції пропорційна концентраціям реагентів.
Сумарна швидкість декількох послідовних перетворень, які значно відрізняються за швидкістю, визначається за швидкістю найповільнішої стадії.
Функціональна залежність швидкості реакції
![]()
від концентрації називається кінетичним рівнянням і має вигляд:
![]() ,
,
де k – константа швидкості реакції,
a,b – порядки реакції за реагентами А та В.
Більшість хімічних реакцій протікають через череду проміжних стадій, які можуть ускладнюватися паралельними та послідовними реакціями. Константи та порядки реакції визначаються дослідним шляхом та залежать від умов проведення процесу.
Швидкість такої реакції по одному з реагентів дорівнює алгебраїчній сумі швидкостей елементарних стадій, в яких ця речовина приймає участь.
При визначенні знаків у членів цієї суми користуються правилом:
швидкість має позитивне значення, якщо вона визначається за продуктом реакції і негативне, якщо вона визначається за реагентом.
Залежність швидкості хімічної реакції від температури визначають за рівнянням Ареніусу:
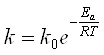 ,
,
де Еа – енергія активації процесу (визначається експериментально);
R – універсальна газова константа;
Т – абсолютна температура.;
k – константа швидкості процесу;
k0 – передекспонент.
Енергія активації в технологічних розрахунках має значення температурного коефіцієнту швидкості процесу.
2. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
2.1 Швидкість гетерогенних ХТП
Гетерогенні процеси характеризуються наявністю двох або більше реагуючих фаз, тому вони проходять з переносом речовини через поверхню розділу фаз, таким чином – вони багатостадійні, це означає, що поруч з однією або кількома хімічними стадіями мають місце дифузійні стадії (перенос речовини від однієї фази до іншої).
Швидкість гетерогенного ХТП – число молей одного з реагентів або продуктів реакції, які реагують або утворюються в одиницю часу на одиниці поверхні розділу фаз.
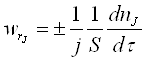
А швидкість дифузійного процесу:
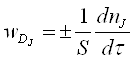
Швидкість
гетерогенного ХТП не може бути більшою ![]() , тому що процеси переносу не
приводять до утворення продукту, але не можуть бути більшою і
, тому що процеси переносу не
приводять до утворення продукту, але не можуть бути більшою і ![]() , так як дифузія передує
хімічній реакції.
, так як дифузія передує
хімічній реакції.
Таким чином при аналізі гетерогенних ХТП виділяють два граничних випадки:
1)
![]() -
процес проходить в дифузійній області, для збільшення продуктивності процесу
необхідно зменшити дифузійне гальмування;
-
процес проходить в дифузійній області, для збільшення продуктивності процесу
необхідно зменшити дифузійне гальмування;
2)
![]() -
процес проходить в кінетичній області і для збільшення продуктивності потребує
інтенсифікації хімічної реакції.
-
процес проходить в кінетичній області і для збільшення продуктивності потребує
інтенсифікації хімічної реакції.
2.2 Кінетичні моделі гетерогенних процесів в системі «Г-Т»
Хімічні перетворення твердих речовин у контакті з газовою фазою часто супроводжуються виникненням нової стабільної або метастабільної твердої фази. Такі реакції відносять до топохімічних. Ці реакції можуть протікати як під дією імпульсів ззовні (термічного, магнітного, звукового, механічного, променевого і т.п.), так і внаслідок реакційної активності взаємодіючих речовин. При цьому знову утворена тверда фаза може бути стійкої або може розкладатися після деякого індукційного періоду. Прикладами топохімічних реакцій є: випал природної мінеральної сировини; розкладання кристалогідратів і інших подвійних сполук; обмінні гетерофазні реакції типу Г-Т; та ін.
Загальні закономірності перетворення твердої речовини в ході топохімічних процесів найкраще описуються рівнянням Єрофеєва:
![]()
Графічне
зображення зміни ступеня перетворення твердої речовини x
від часу це криві лінії, що мають S-образну форму (сигмоїда за Дельмоном).
(рис.1 ) На початковій ділянці 0 – 1 кривої рис. 1 швидкість перетворення ![]()
![]() досить висока оскільки
перетворення протікає на первинній поверхні, яка має найбільший розмір. Потім
швидкість перетворення сповільнюється й в індукційному періоді (ділянка 1–2)
воно протікає із меншою швидкістю
досить висока оскільки
перетворення протікає на первинній поверхні, яка має найбільший розмір. Потім
швидкість перетворення сповільнюється й в індукційному періоді (ділянка 1–2)
воно протікає із меншою швидкістю ![]() .
.
У період
прискорення (ділянка 2–3 ) швидкість перетворення найбільша ![]() .
.
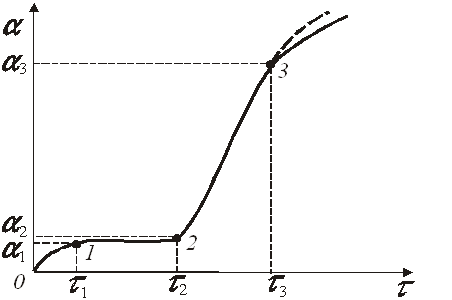
Рис.1. Загальний вид зміни ступеня перетворення від часу
Прискорення пов’язано з розвиненням реакційної поверхні із-за нерівномірності витрат твердої речовини на різних ділянках поверхні. За цим періодом випливає період спаду швидкості перетворення це пов’язано зі зменшенням кількості реагенту в ході хімічної реакції. Усі ці ділянки одночасно представляються тільки на теоретичному графіку.
На графіках, побудованих за експериментальними даними, звичайно відбивають якісь переважаючі ділянки залежності α = φ(τ), характерні для основних етапів розвитку топохімічного перетворення. Наявність переважаючої ділянки залежить від реакційної поверхні, характеру перетворення, порушень кристалічних решіток, співвідношення молярних об’ємів вихідної фази і фази, що утворюється, форми і числа зародків, а також від особливостей швидкості зростання числа ядер зародків від часу.
Між тим вважають, що рівняння Єрофеєва, не зважаючи на свою універсальність не відображує механізму процесу, тому, що в результаті експериментальних досліджень можуть бути отримані значення показника ступені, які позбавлені фізичного змісту. Тому, для опису кінетики перетворень в системі Г-Т застосовують інші моделі. Найпопулярніші з них – квазігомогенна модель та модель з фронтальним переміщенням зони реакції.
2.3 Модель з фронтальним переміщенням зони реакції
Відповідно до цієї моделі процес проходить спочатку на зовнішній поверхні частинки, доти доки зовнішній шар твердого реагенту повністю не перетвориться в тверді або газоподібні продукти реакції більш глибокі шари твердого реагенту в реакцію не вступають. (рис.2)
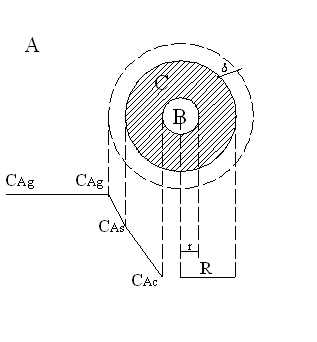
В довільний момент часу тверда частинка являє собою внутрішнє ядро, яке оточене зовнішньою оболонкою, яка складається з твердого продукту та інертних речовин.
Такий процес можна розділити на такі 5 етапів:
1)Зовнішня дифузія – постачання газоподібного реагенту до поверхні твердої частинки через шар газу, який збіднений цим реагентом.
2)Внутрішня дифузія – проникнення газоподібного реагенту через пори твердого продукту до поверхні ядра твердого реагенту.
3)Хімічна реакція на поверхні ядра твердого реагенту.
4)Внутрішня дифузія газоподібного продукту через шар твердого продукту.
5)Зовнішня дифузія газоподібного продукту в реакційний об’єм.
На загальну швидкість процесу впливає швидкість окремих його стадій.
Зовнішня дифузія.
![]()
Нехай межа шару зі зниженою, у порівнянні з газовим потоком, концентрацією реагенту А знаходиться на відстані δ від твердої частинки, таким чином навколо твердої частинки існує плівка речовини А. Переніс речовини А з газового потоку до поверхні через граничну газову плівку здійснюється за рахунок конвекційної дифузії, для визначення швидкості якої користуються рівнянням:
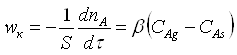 ,
,
де ![]() - коефіцієнт
масовіддачі (D – коефіцієнт
молекулярної дифузії, δ – товщина плівки). Інтенсифікувати процес
зовнішньої дифузії можна зменшуючи товщину плівки δ шляхом збільшення
швидкості газового потоку або перемішуванням твердих частинок (використання
апаратів з киплячим шаром).
- коефіцієнт
масовіддачі (D – коефіцієнт
молекулярної дифузії, δ – товщина плівки). Інтенсифікувати процес
зовнішньої дифузії можна зменшуючи товщину плівки δ шляхом збільшення
швидкості газового потоку або перемішуванням твердих частинок (використання
апаратів з киплячим шаром).
Внутрішня дифузія.
Якщо в результаті гетерогенної взаємодії газоподібного та твердого реагентів утворюються тверді продукти реакції, то стадією яка передує хімічній реакції буде внутрішня дифузія, або проникнення газу через шар твердого продукту до поверхні ядра.
![]() ,
,
де Dеф – ефективний коефіцієнт дифузії, що враховує пористість твердої речовини, форму та розмір пор.
Так як шар
твердої речовини вчинює опір руху речовини А, то концентрація його біля ядра ![]() , якщо товщина
шару твердого продукту невелика, то
, якщо товщина
шару твердого продукту невелика, то
![]() ,
,
Таким чином:
![]()
Збільшити її
швидкість, також як у випадку зовнішньої дифузії можна за рахунок зменшення ![]() - здрібнення
твердих частинок.
- здрібнення
твердих частинок.
Поверхнева хімічна реакція
Швидкість хімічної реакції описується законами хімічної кінетики.
![]()
де kS – константа швидкості хімічної реакції.
Швидкість хімічної реакції може бути збільшена за рахунок збільшення СА в газовому потоці, що оточує тверді частинки, або збільшення kS з ростом температури згідно рівнянню Ареніуса.
Загальна швидкість гетерогенного процесу.
Представлені вище рівняння дозволяють розрахувати швидкості окремих стадій гетерогенного процесу. Оскільки вони протікають не ізольовано, а у взаємодії друг з другом при визначенні загальної швидкості процесу слід враховувати всі стадії.
В стаціонарних умовах:

Після сумації цих рівнянь одержимо:
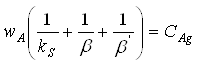
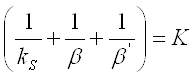
Отже загальна швидкість процесу:
![]()
У випадку, коли одна зі стадій є обтяженою, а це означає, що її опір перевищує опір інших стадій, швидкість цієї стадії визначає швидкість процесу в цілому. Така стадія називається лімітуюча.
Якщо відомо, яка зі стадій процесу є лімітуючою доцільно проводити розрахунки реакторів використовуючи нижченаведені залежності між часом перебування частинок в реакторі та ступенем перетворення твердого реагенту.
1.Процес лімітується зовнішньою дифузією:
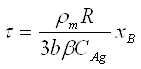
2.Процес лімітується внутрішньою дифузією:
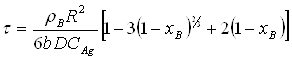
3.Процес лімітується хімічною реакцією:

2.4 Гетерогенні процеси в системі газ-рідина
Процеси з участю рідких та газоподібних реагентів широко використовуються. До них відносяться абсорбція та десорбція газів, випарювання та конденсація парів, дистиляція та ректифікація рідких сумішей, піроліз рідин, полімеризація в газах з утворенням рідких полімерів.
Абсорбція – процес поглинання газу рідиною з утворенням розчину, якщо абсорбція супроводжується хімічною реакцією, вона називається хемосорбцією. (Процес абсорбції двооксиду вуглецю розчинами моноетаноламіну у виробництві аміаку). Десорбція - процес зворотній абсорбції – виділення з рідини розчинених в ній газів. На практиці десорбцію називають відгонкою і проводять нагріваючи рідину, або пропусканням через неї інертного газу чи водяної пари. (Процес вилучення двооксиду вуглецю з розчинів моноетаноламіну у виробництві аміаку)
2.5 Швидкість процесів в системі газ-рідина
Зручно розглядати на прикладі абсорбції. Якщо процес протікає в дифузійній області, швидкість його визначають за швидкість дифузії:
![]() ,
,
де р та р* - порційні тиски газу фактичний та рівноважний;
F – міжфазна поверхня (поверхня більш важкої фази – рідини);
![]() -
коефіцієнт масопередачі, виражений в одиницях порційного тиску.
-
коефіцієнт масопередачі, виражений в одиницях порційного тиску.
Швидкість десорбції розраховують за рівнянням:
![]() ,
,
де с та с* - концентрації розчиненого реагенту, фактична та рівноважна;
![]() -
коефіцієнт масопередачі, виражений в одиницях концентрації.
-
коефіцієнт масопередачі, виражений в одиницях концентрації.
При дослідженні хемосорбційних процесів необхідно враховувати також швидкість хімічної реакції, у випадку її подібності швидкості дифузії:
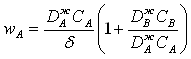
![]() ,
,
де δ – товщина граничного шару;
![]() -
коефіцієнти дифузії;
-
коефіцієнти дифузії;
СА, СВ – концентрації речовин А та В.
Способи прискорення процесів.
Вибір того чи іншого способу збільшення швидкості процесу залежить від області його протікання. Якщо реакція протікає в кінетичній області, то для її прискорення використовують збільшення температури та початкових концентрацій реагентів, а також збільшення тиску. Швидкість процесу, що протікає в дифузійній області збільшують:
a) розвитком міжфазної поверхні;
b) турбулізацією та інтенсивним перемішуванням газу та рідини для збільшення коефіцієнту масопередачі;
c) збільшенням початкової концентрації газоподібних реагентів.
Висновки
При написанні реферату були розглянути теми:
1. Хіміко-технологічні процеси - складова хімічного виробництва;
2. Кінетичні закономірності гетерогенних хіміко-технологічних процесів;
та питання:
- Класифікація хімічних реакцій, на яких засновані ХТП ;
-Фізико-хімічні закономірності хіміко-технологічних процесів;
- Рівновага в хіміко-технологічних процесах;
- Вплив умов протікання реакції на стан рівноваги;
- Кінетичні закономірності ХТП;
- Швидкість гомогенних хімічних реакцій;
- Залежність швидкості хімічних реакцій від концентрації реагентів;
- Швидкість гетерогенних ХТП;
- Кінетичні моделі гетерогенних процесів в системі «Г-Т»;
- Модель з фронтальним переміщенням зони реакції;
- Гетерогенні процеси в системі газ-рідина;
- Швидкість процесів в системі газ-рідина;
- Способи прискорення процесів та ін..
Література
1. Мухленов И.П. и др. Общая химическая технология. – М.: Высшая школа, 1991.-С. 25-29, 228, 164-191
2. Кутепов А.М. и др. Общая химическая технология. – М.: Высшая школа, 1990.-С. 27-39, 60-88