
Рефераты по международному публичному праву
Рефераты по международному частному праву
Рефераты по международным отношениям
Рефераты по культуре и искусству
Рефераты по менеджменту
Рефераты по металлургии
Рефераты по муниципальному праву
Рефераты по налогообложению
Рефераты по оккультизму и уфологии
Рефераты по педагогике
Рефераты по политологии
Рефераты по праву
Биографии
Рефераты по предпринимательству
Рефераты по психологии
Рефераты по радиоэлектронике
Рефераты по риторике
Рефераты по социологии
Рефераты по статистике
Рефераты по страхованию
Рефераты по строительству
Рефераты по таможенной системе
Сочинения по литературе и русскому языку
Рефераты по теории государства и права
Рефераты по теории организации
Рефераты по теплотехнике
Рефераты по технологии
Рефераты по товароведению
Рефераты по транспорту
Рефераты по трудовому праву
Рефераты по туризму
Рефераты по уголовному праву и процессу
Рефераты по управлению
Контрольная работа: Исследование уравнений реакций
Контрольная работа: Исследование уравнений реакций
1. Рассчитайте молярную массу эквивалентов воды при реакции
а) с металлическим натрием;
б) с оксидом натрия.
Решение:
а) 2Na + 2H2O = 2NaOH + H2h
Из закона эквивалентов:
![]()
![]()
где ne – число отданных Na электронов.
![]()
б) Na2O + H2O = 2NaOH
Из закона эквивалентов:
![]()
![]()
где n – число катионов соответствующих оксиду основания Na2O.
|c.o| – абсолютное значение степени окисления катиона Na
![]()
2. Назовите элементы, внешний энергетический уровень атомов который выражается электронной конфигурацией np4. Напишите полную электронную конфигурацию атома одного из этих элементов и укажите электронное семейство
Решение
Элементы, внешний энергетический уровень атомов которых выражается электронной конфигурацией np4 являются:
Кислород 8 O 2s22p4 1s22s22p4
Сера 16 S 3s23p4 1s22s22p63s23p4
Селен 34 Se 4s24p4 1s22s22p63s23p64s23d104p4
Теллур 52 Te 5s25p4 1s22s22p63s23p64s23d104p65s24d105p4
Полоний 84 Po 6s26p4 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p4
Все вышеперечисленные элементы принадлежат к p – электронному семейству.
3. Исходя из положения металла в Периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: а) Mg(OH)2 или Ba(OH)2; б) Ca(OH)2 или Co(OH)2; в) Ca(OH)2 или Zn(OH)2? Напишите уравнения реакций, доказывающих амфотерность гидроксида цинка
Внутри подгруппы с увеличением заряда ядра возрастают металлические свойства и ослабевают неметаллические, следовательно, усиливаются основные свойства их соединений и ослабевают кислотные свойства.
а) В главной подгруппе сверху вниз периодической системы усиливается основной характер гидроксидов: из пары Mg(OH)2 и Ba(OH)2 более сильным основанием будет являться Ba(OH)2;
В периоде с лева на право основной характер гидроксидов постепенно ослабляется, сменяясь амфотерностью к кислотным свойствам внутри периода, т.к. анионам легче присоединять электроны чем отдавать;
б) В паре Ca(OH)2 и Co(OH)2 более сильным будет Ca(OH)2 т. к. элемент кобальт является d-элементом (не заполненный d-подуровень), и будет склонен к комплексообразованию, также они находятся в разных подгруппах;
в) В паре Ca(OH)2 и Zn(OH)2 более сильным основанием будет Ca(OH)2 т.к. находятся в разных подгруппах и цинк будет склонен к комплексообразованию (d-элемент, наличие свободных f-орбиталей)
ZnCl2 +NaOH = Zn(OH)2 +NaCl – cоли цинка взаимодействуют со щелочами образуя гидроксид
Zn(OH)2+HCl=ZnCl2+H2O – гидроксид цинка при взаимодействии с кислотами растворяется образуя соль
Zn+ H2O+2KOH=K2[Zn(OH)4]+H2h – при переизбытке щелочи Zn образует комплексные соединения
Zn +2NaOH = Na2ZnO2 + H2h
Zn+2HCl=ZnCl2+H2h
4. При растворении 16 г. CaC2 в воде выделяется 31,27 кДж теплоты. Определить стандартную энтальпию образования Ca(OH)2
CaC2 кр+ 2H2Oжид = Ca(OH)2кр+ C2H2газh-rHp
1) Рассчитаем сколько количество молей CaC2 прореагировало:
М (CaC2)=64 г/моль
M(CaC2)=16 г
![]()
2) т.е. при взаимодействии 0,25 моля СаС2 выделяется – 31,27 кДж теплоты, а т.к. стандартная энтальпия рассчитывается на 1 моль вещества, то рассчитываем сколько тепла выделится при взаимодействии 1 моля СаС2
0,25 моля выделится – 31,27 кДж теплоты
1,0 моля выделится – х кДж теплоты
![]()
3) исходя из таблицы «стандарт энтальпии образований» находим стандартные энтальпии веществ:
rH(СаС2кр)=-62,7 кДж
rH(H2Oж)=-285,8 кДж
rH(C2H2газ)= 226,8 кДж
4) Исходя из уравнения rHp рассчитывается как:
rHp=∑rH(продуктов) – ∑rH (исходных веществ);
rHp=(rH (Ca(OH)2кр)+ rH(C2H2г)) – (rH(CaC2кр)+2rH(H2Oж)) =>
rHp=rH (Ca(OH)2кр+ rH(C2H2г) – rH(CaC2кр) – 2rH(H2Oж), находим rH (Ca(OH)2кр:
rH (Ca(OH)2кр=rHp – rH(C2H2г) + rH(CaC2кр) + 2rH(H2Oж) подставим значения стандартных энтальпий в уравнение:
rH (Ca(OH)2кр=-125,08 – (226,8)+(-62,7)+2*(-285,8)=-125,08–226,8–62,7–2*285,8= = – 986,18кДж/моль
Ответ: -986,2 кДж/моль
5. При состоянии равновесия системы N2 +3H2 ↔ 2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление увеличить в 4 раза. В каком направлении сместится равновесие?
Для решения воспользуемся законом действия масс.
1. Записываем математическое выражение для начальной скорости прямой и обратной реакции
ϑн(п) = k ∗ CN2 ∗ (CH2)3
ϑн(о) = k ∗ (СNH3)2
2. Записываем математическое выражение для конечной скорости прямой обратной реакции (после увеличения давления в 4 раза)
ϑк(п) = k ∗ 4 ∗ CN ∗ (4∗CH2)3 = k ∗ 256 ∗ CN ∗ (CH2)3
ϑк(о) = k ∗ (4∗СNH3)2 = k ∗ 16 ∗ (СNH3)2
3. Найдём отношение скоростей прямой и обратной реакции
ϑк(п) k ∗ 256 ∗ CN ∗ (CH2)3
ϑн(п) k ∗ CN2 ∗ (CH2)3
6. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) BaCO3 и HNO3; б) Fe2(SO4)3 и KOH; в) HCl и K2S; г) CH3COOK и HCl
молекулярный реакция амфотерность уравнение
а) BaCO3 â+ 2HNO3 = Ba(NO3)2 + H2CO3h
BaCO3â+2Н2++2NO3- = Ba2+ +2NO3 – +2H+ + CO32-
BaCO3â= Ba2+ + CO32-
б) Fe2(SO4)3+6KOH=2Fe(OH)3â+3K2SO4
2Fe3+ +3SO42 – +6K+ +6OH – =2Fe(OH)3â+6K+ +3SO42-
2Fe3+ +6OH – =2Fe(OH)3â
в) 2HCl+K2S=H2S+2KCl
2H++2Cl – +2K+ +S2 – =2H+ +S2 – +2K+ +2Cl-
В реакции прореагировали все вещества, но ионная реакция сопровождается образованием газа (сероводорода), тогда:
2HCl+K2S=H2Sh+2KCl
2H++2Cl - +2K+ + S2- = H2Sh +2K+ +2Cl -
2H+ +S2- = H2Sh
г) CH3COOK+HCl=CH3COOH+KCl
CH3COO - + K++H++Cl – =CH3COO - + H++ K+ +Cl –
CH3COO - + K++H++Cl – =CH3COОН + K+ +Cl -, слабый элетролит CH3COОН
CH3COO - + H+ =CH3COОН
7. Чему равна величина ЭДС гальванического элемента, составленного из стандартных цинкового и серебряного электродов, погруженных в растворы их солей? Приведите схему гальванического элемента и реакции, и реакции протекающие на электродах при его работе
Схема гальванического элемента:
(–) Zn | Zn2+ || Ag+ | Ag (+)
На аноде протекают реакции: Zn0-2e=Zn2+
На катоде протекают реакции: Ag++e=Ag0
Т.к. потенциал Е0(Ag)> Е0(Zn)
Е0(Ag+ |Ag)= +0,80В
Е0(Zn2+ | Zn)= -0,763В
то на серебряном электроде будет протекать восстановление (будет являться катодом), а на цинковом электроде будет протекать окисление (он будет анодом);
Потенциал гальванического элемента:
Е = Е0катода – Е0анода =0,80 – (-0,763)=1,562В
Ответ: 1,562 В.
8. Изделие из алюминия склёпано медью. Какой из металлов будет подвергаться коррозии с водородной деполяризацией, если эти металлы попадут в кислую среду (HCl)? Составьте уравнения проходящих при этом процессов, приведите схему образующегося гальванического элемента. Определите продукты коррозии
В реакциях с кислотами атомы алюминия окисляются ионами водорода в ионы алюминия, которые переходят в раствор:
2Al+6H+→2Al3+ +3H2h
Медь в электрохимическом ряду напряжения металлов находится за водородом, (т.е. её стандартный потенциал положительный) и с разбавленными кислотами не реагирует (положительно заряженные ионы меди не переходят в раствор).
В кристаллической решетке меди (в отличие от алюминия) свободные электроны не накапливаются. При соприкосновении этих двух металлов свободные электроны алюминия переходят к меди и восстанавливают на её поверхность ионы водорода:
2H+ +2e→H2h
Продуктами коррозии будет являться результат взаимодействия алюминия с соляной кислотой:
2Al+6HCl→2AlCl3+3H2h
Образуется гальванический элемент:
(–) Al |AlCl3|Cu(+)
Анод катод.
9. При электролизе водных растворов каких из приведённых ниже веществ на катоде выделяется только металл: хлорид бария, хлорид меди (II), иодид калия, нитрат серебра, сульфид натрия? Приведите соответствующие уравнения электродных процессов
При электролизе водных растворов катионов металлов, у которых стандартный электродный потенциал больше чем водорода (Е0>>-0,41В) на катоде восстанавливаются только катионы металлов. В данном случае это хлорид меди (II) и нитрат серебра:
|
(–) Катод
![]()
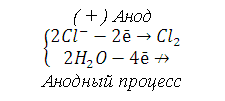
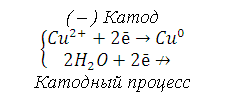
Суммарный процесс электролиза:
![]()
Суммарный процесс электролиза:
![]()
Суммарное молекулярное уравнение электролиза:
![]() .
.
Библиографический список
1. Будякк Е.В. Химия: учеб. пособие Иркутск: Изд-во ИрГТУ, 2008. – 160 с.
2. Коровин Н.В. Общая химия. М. Высш. шк., 2002. 558 с.
3. Кузнецова А.А. Химия: метод. указания по освоению дисциплины для студентов заочной формы обучения. Иркутск: Изд-во ИрГТУ, 2010. 44 с.
4. Химия: метод. указания, программа, решение типовых задач и контрольные задания для студентов заочного обучения технических направлений и специальностей / сост.: В.И. Дударев, В.П. Зуева, О.В. Лебедева, Ю.Н. Пожидаев, З.Н. Топшиноева, А.Н. Шибанова. Иркутск: Изд-во ИрГТУ, 2007. 92 с.