
Рефераты по международному публичному праву
Рефераты по международному частному праву
Рефераты по международным отношениям
Рефераты по культуре и искусству
Рефераты по менеджменту
Рефераты по металлургии
Рефераты по муниципальному праву
Рефераты по налогообложению
Рефераты по оккультизму и уфологии
Рефераты по педагогике
Рефераты по политологии
Рефераты по праву
Биографии
Рефераты по предпринимательству
Рефераты по психологии
Рефераты по радиоэлектронике
Рефераты по риторике
Рефераты по социологии
Рефераты по статистике
Рефераты по страхованию
Рефераты по строительству
Рефераты по таможенной системе
Сочинения по литературе и русскому языку
Рефераты по теории государства и права
Рефераты по теории организации
Рефераты по теплотехнике
Рефераты по технологии
Рефераты по товароведению
Рефераты по транспорту
Рефераты по трудовому праву
Рефераты по туризму
Рефераты по уголовному праву и процессу
Рефераты по управлению
Реферат: Белок - основа жизни
Реферат: Белок - основа жизни
Глава II
Программа спецкурса „Белок – основа жизни”.
2.1. Объяснительная записка.
Предлагаемая программа спецкурса „Белок – основа жизни” предназначена для учащихся X-XI классов. Программа построена с учетом имеющихся знаний у учащихся по химии и биологии, она направлена на рассмотрение, углубление этих знаний, а также на формирование правильного понимания жизненных процессов. Преподавание спецкурса необходимо построить в зависимости от уровня подготовленности учащихся. Материал для преподавания в X классе может быть несколько упрощен, но не сведен лишь к изучению биологических функций белков.
При изучении спецкурса „Белок – основа жизни” в X классе рекомендуем подробно остановиться на вопросах, касающихся особенностей белковых тел как носителей жизни, аминокислотного состава белков, свойств белков и их функций организме человека.
При изучении спецкурса в XI классе следует особое внимание уделять химическому строению, структурам белковых молекул, методам выделения и очистки белков, их биологическому действию в живых организмах.
Спецкурс рассчитан на 30 часов, из них 14 часов отводится на лекции, 9 часов – на выполнение лабораторных работ, 5 часов – на семинарские занятия.
При проведении спецкурса предусмотрен учет и контроль знаний учащихся. Проверка знаний может осуществляться с помощью контрольных работ, опроса на занятиях, индивидуальных бесед, тестовых заданий.
В вариант программы могут быть внесены некоторые изменения: перестановка тем, включение некоторых дополнительных вопросов для изучения. Изменения в планирование спецкурса могут быть внесены из-за отсутствия необходимого набора реактивов в кабинете химии. Однако внесенные изменения не должны нарушать логическую структуру курса и существенно отражаться на объеме и уровне знаний учащихся. Предлагаемый курса „Белок – основа жизни” может быть использован как факультативные занятия по химии, биологии или как межпредметный комплекс.
Разработанный нами спецкурс может способствовать интеграции химии с другими естественнонаучными дисциплинами, позволяет знакомить учащихся с процессами, протекающими в окружающей среде, в организме человека и животных и приближает изучение химии к жизни.
2.2. Рабочая программа спецкурса
I. Введение
Химический состав организмов. Общее знакомство с белками. Роль белковых тел в построении живой материи и в осуществлении процессов жизнедеятельности. Особенности белковых тел как носителей жизни. Современные представления о сущности жизни и роли белков в её осуществлении.
II. История открытия и изучения белков.
Внедрение первого препарата белкового вещества. Работы Я.Б. Беккари. Эксперименты с белковыми веществами растительного происхождения (И.М.Руэль, А. Пармантье и др.). Экспериментальные работы с белковыми веществами животного происхождения (Ф. Кене, Ф. Вассерберг, И. Пленк).
Попытки А. Ф. Фукруа по установлению строения белков и сравнению белковых веществ различных тканей и жидкостей живого организма.
Первые данные об элементарном составе белков (Гей-Люссак и Тенар).
Работы по установлению эмпирических формул белковых веществ (Ш.А.Вюрц, Э. Бауленхауер, Э. Фреши и А. Валансьен и др.).
Открытие аминокислот (Л.Н. Воклен, У.Г. Волластон, Г. Мульдер, А. Браконно и др.).
Способ связи аминокислот в белковой молекуле. Работы А.Я. Данилевского и Э. Фишера. Синтез первого дипептида. Развитие представлений о структурах белковой молекулы (К.У. Линдерстрем-Ланг и др.).
Отечественная химия белка до 50-х годов XX-века. Открытие Московского биохимического института (1921). Работы Н.Д. Зелинского как логическое продолжение работ Э. Фишера.
Физико-химические методы исследования белков в 30-40 гг. XX века (Д.Л. Талмуд, П.В. Афанасьев и др.). Вклад Ф.И. Гизе, А.И. Коднева, П.Т. Ильенкова, А.Я. Данилевского, А.П. Сабанеева, Н.Н. Любавина и других отечественных ученых в развитие представлений о химическом строении белка.
III. Элементарный состав белков. Методы выделения и фракционирования белков.
Основные химические элементы, входящие в состав белка, их процентное содержание. Понятие о факторе пересчета.
Способы гомогенизации материала: размалывание на специальных мельницах, измельчение в гомогенизаторах Уорринга и Поттера, ультразвуком, попеременным замораживанием и оттаиванием, осмотическим шоком, методом азотной бомбы. Экстракция белков растворами солей, буферными смесями (фосфатный, цитратный, боратный), органическими растворителями (водными растворами одно- и многоатомных спиртов, уксусной и дихлоруксусной кислот, ацетона и др.). Методы фракционирования белков: высаживание, осаждение органическими растворителями (метиловым и этиловым спиртами, ацетоном, диоксаном и др.); осаждение солями тяжёлых металлов (Hg2+, Zn2+, Ca2+, Ba2+, Pb2+, Cu2+, и др.), электрофорез жидкостный, на бумаге и блоке агар-агара.
Лабораторно – практические работы:
1. „Выделение белков из тканей и биологических жидкостей“.
„ Реакции осаждения белков“.
IV. Гомогенность и молекулярная масса белков.
Способы очистки белковых препаратов от низкомолекулярных примесей: диализ, электродиализ, кристаллизация и ильфильтрация. Методы определения гомогенности белковых препаратов: по независимости растворимости от количества твердой фазы, по хроматографической, электроогорепической и гравитационной однородности, по кристалличности, по содержанию HS-группы и концевых аминокислот.
Молекулярная масса белков. Понятие о физическом и химическом значениях молекулярной массы белков.
Методы определения молекулярной массы белка: гравитационный (ультрацентрифугирование), вискозометрический, осмометрический, электронно-микроскопический, хроматографический, химический, оптический.
Ультрацентрифуги и их достоинство.
Лабораторно-практическая работа:
„Диализ белка“.
V. Аминокислотный состав белков.
Аминокислоты – основные структурные элементы всех белков. Разнообразие аминокислот. Природные аминокислоты. Понятие о рацемических и оптических активных аминокислотах. Особое значение для жизни α-аминокислот.
Заменимые и незаменимые для человека аминокислоты.
VI. Строение белковой молекулы.
Способ связи аминокислот в белковой молекуле. Работы А.Я. Данилевского и Э. Фишера. Пептиды. Методы синтеза пептидов. Синтез пептидов по методу Р. Меррифильда.
Природные пептиды: карнозин, глутатион, офтальмовая кислота, окситоцин, вазопрессин, ораллондин и др.
Структура белковой молекулы. Доказательства полипептидной теории строения белка.
Первичная структура белков. Схема установления первичной структуры белка.
ОпределениеN- и C-концевых аминокислот, расщепление дисульфидных связей и окисление остатков цистеина в цистеиновую кислоту, селективный гидролиз трепсином и химотрипсином, фракционирование пептидов методом электрофореза и хроматографии, расшифровка первичной структуры выделенных пептидов, воссоздание полной структуры полипептидной цепи. Характеристика первичной структуры A- и B-цепей инсулина, α- и β-цепей гемоглобина и других белков. Первичная структура и видовая специфичность белков.
Вторичная структура белков. Понятие об α- и β-конформациях полипептидной цепи. Правые и левые α-спирали, их реализация в белках и пептидах. Силы, удерживающие полипептидную цепь в α-конформации. Связь первичной вторичной структуры белковой молекулы. Степень спирализации полипептидных цепей белков.
Третичная структура белков. Методы её выявления. Работы Дж. Кендрю, М. Петруца и Филипса по рентгеноструктурному анализу третичной структуры гемоглобина. Типы связей, обеспечивающих поддержание структуры белковой молекулы. Гидрофобные зоны в молекулах глобумерных белков. Приоритет отечественных исследователей (Д.Л. Талмуда, Б.Н. Талмуда и П.В. Афанасьева) в разработке учения об ориентации гидрофобных и гидрофильных радикалов в процессе свёртывания полипептидной цепи в глобулу. Динамичность третичной структуры белков.
Четвертичная структура белков. Субъединицы, протомеры и эпимолекулы (мультимеры). Конкретные примеры четвертичной структуры белков (инсулин, гемоглобин, вирус табачной мозаики и т.п.). Типы связей между субъединицами в эпимолекуле.
Лабораторно-практические работы:
„Кислотный и ферментативный гидролиз белка“.
„Биуретовая и мингидриновая реакции на белки“.
VII. Свойства белков
Реакционная способность белков. Химические свойства белков. Оптические свойства белков. Амфотерность. Гезоэлектическое состояние белковой молекулы. Нативные и денатурированные белки. Механизм денатурации белков.
Лабораторные работы:
„Качественные реакции на белки“.
VIII. Номенклатура и классификация белков.
Простые (протеины) и сложные (протеиды) белки. Классификация протеинов по форме белковой молекулы, по происхождению, по аминокислотному составу. Характеристика некоторых простых белков (клупеин, фиброин шёлка, яичный и сывороточный альбумины). Классификация протеидов. Белковый компонент и прстепическая? Группа в протеидах. Металлопротеиды (феррипин). Фосфопротеины (казеин, фосфопротеиды яйца, пепсин). Гликопротеиды, хромопротеиды, мепопротеиды? Нуклеотиды; тонкая организация их структуры.
IX. Биологические функции белков.
Белки – ферменты. Белки – гормоны. Белки – антибиотики и др. Характеристика наиболее изученных представителей белков и полипептидов: окситоцин, вазопрессин, инсулин, гормон роста, рибонуклеаза, интерфероны и некоторые другие. Превращение белков в организме.
X. Современные исследования в области химии белка.
Органическая химия и биохимия: подходы к изучению сложных природных соединений. Синтез аминокислот и белков. Формирование энзимологии. Изучение химической природы биокатализаторов.
Химия и клетка. Химические методы изучения клетки. Цитохимия и биохимия, проблема организации клетки.
Биохимические исследования в медицине.
Создание биохимических кафедр и лабораторий.
2.3. Планирование спецкурса „Белок – основа жизни“ для изучения в XI классе средней школы.
При планировании спецкурса мы учитывали рекомендации данные в методической литературе [7,18,22,28].
Поскольку учащиеся имели весьма ограниченные знания по обозначенной проблеме, мы отобрали для изучения наиболее интересные темы с тем, чтобы заинтересовать их, развить навыки экспериментальной работы в школьной химической лаборатории и развить умение самостоятельной работы с литературой.
Нами также учитывался уровень подготовленности учащихся, и поэтому мы сочли нужным разработать планирование спецкурса для XI классов средней школы.
Таблица. Тематическое планирование спецкурса „Белок – основа жизни“.
|
№ занятия |
Содержание изучаемого материала | Темы методы и средства обучения | Количество часов |
| 1 |
I. Введение Химический состав организмов. Общее знакомство с белками. Особенности белковых тел как носителей жизни. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация наглядных пособий (иллюстраций, фотографий, таблиц). |
1 |
| 2 |
II. История открытия и изучения белков. Выделение первого препарата белкового происхождения. Попытки установления строения белков. Данные об элементарном составе белков. Работы зарубежных учёных-химиков. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация фотографий, таблиц, белковых препаратов. |
1 |
| 3 | Отечественная химия белка до 50-х годов XX века. Работы отечественных учёных-химиков. |
Семинар. Словесные: рассказ учителя, доклады и содоклады учащихся. Наглядные: демонстрация фотографий, схем, таблиц. |
1 |
| 4 |
III. Элементарный состав белков. Методы выделения и фракционирования белков. Основные химические элементы входящие в состав белка. Способы гомогенизации и экстракция белков. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация таблиц, демонстрационный эксперимент. Лабораторно-практическая работа. |
1 |
| 5-6 |
Лабораторно-практическая работа: „Выделение белков из тканей биологических жидкостей“.
|
Словесные: беседа. Наглядные: демонстрация приборов, схем, таблиц. Наглядно-действенные: выполнение практической работы. |
2 |
| 7 | Методы фракционирования белков. Способы очистки белковых препаратов от низкомолекулярных примесей. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация схем, таблиц, демонстрационный эксперимент. |
1 |
| 8-9 |
Лабораторно-практическая работа: „Реакции осаждения белков“.
|
Лабораторно-практическая работа: Словесные: беседа. Наглядные: демонстрация схем, таблиц, приборов. Наглядно-действенные: выполнение практической работы. |
2 |
| 10-11 |
IV. Гомогенность и молекулярная масса белков. Методы определения гомогенности белковых препаратов. Методы определения молекулярной массы белка. Ультрацентрифуги и их устройство. |
Лекция. Словесные: рассказ, фронтальная беседа. Наглядные: демонстрация таблиц, рисунков, схемы „Устройство центрифуги“. |
2 |
| 12 |
Лабораторно-практическая работа: „Диализ белка“. |
Лабораторно-практическая работа: Словесные: беседа. Наглядно-действенные: выполнение практической работы. |
1 |
| 13-14 |
V. Состав белков. Аминокислотный состав белков. Разнообразие аминокислот. Природные аминокислоты. Особое значение для жизни α-аминокислот. Заменимые и незаменимые для человека аминокислоты. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация таблиц „Аминокислоты, постоянно встречающиеся в составе белка для взрослого организма“, рисунков, схем. |
2 |
| 15 | Семинарское занятие „Методы выделения и фракционирования белков. Природные аминокислоты. Заменимые и незаменимые для человека аминокислоты“ |
Семинар. Словесные: рассказ учителя, доклады и содоклады учащихся, беседа. Наглядные: демонстрация таблиц, схем, фотографий. |
1 |
| 16 | Контрольная работа |
Контроль знаний. Словесные: беседа. Наглядные: таблицы, схемы. |
1 |
| 17 |
VI. Строение белковой молекулы. Способ связи аминокислот в белковой молекуле. Работы А.Я. Данилевского и Э. Фишера. Пептиды. Доказательство полипептидной теории строения белка. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрационный эксперимент, таблицы, схемы установок |
1 |
| 18 |
Лабораторно-практическая работа: „Гидролиз белка“.
|
Лабораторно-практическая работа. Словесные: беседа. Наглядно-действенные: выполнение практической работы. |
1 |
| 19 | Первичная структура белков. Схема установления первичной структуры белка. Характеристика первичной структуры А- и В-цепей инсулина; α- и β- цепей гемоглобина. |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация таблиц, рисунков, схемы установки первичной структуры белка. |
1 |
| 20 | Вторичная структура белков. Понятие об α- и β-конформациях полипептидной цепи. Правые и левые α-спирали, их реализация в пептидах и белках |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрация таблиц, рисунков. |
1 |
| 21 |
Третичная структура белков. Методы её выявления. Типы связей, обеспечивающих поддержание структуры белковой молекулы. Четвертичная структура белков. Конкретные примеры четвертичной структуры белков (инсулин, гемоглобин, вирус табачной мозаики и др.). |
Лекция. Словесные: лекция Наглядные: демонстрация фотографий „Третичная структура белка“, „Четвертичная структура белка“. Демонстрация моделей белков: инсулина, гемоглобина и др. |
1 |
| 22-23 |
VI. Свойства белков. Химические, физические. Аморфность. Изоэлектрическое состояние белковой молекулы. Механизм денатурации белков. Лабораторная работа: „Денатурация белков“ |
Лекция. Словесные: рассказ, беседа. Наглядные: демонстрационный эксперимент, иллюстрирующий химические свойства белков. Наглядно-действенные: выполнение лабораторной работы. |
2 |
| 24-25 |
Лабораторно-практическая работа: „Качественные реакции на белки“. |
Лабораторно-практическая работа. Словесные: беседа. Наглядно-действенные: выполнение практической работы. |
2 |
| 26 | VII. Номенклатура и классификация белков. |
Лекция. Словесные: рассказ, беседа. Наглядные: таблицы. |
1 |
| 27 | Характеристика некоторых простых и сложных белков. |
Семинар. Словесные: доклады учащихся. Наглядные: демонстрация фотографий и моделей. |
1 |
| 28 | VIII. Биологические функции белков. |
Семинар. Словесные: рассказ учителя, доклады учащихся. Наглядные: демонстрация белковых препаратов, схем, таблиц. |
1 |
| 29 | IX. Современные исследования в области химии белка. |
Семинар. Словесные: рассказ учителя, доклады учащихся. Наглядные: демонстрация схем, фотографий, моделей. |
1 |
| 30 | Контрольная работа. |
Контроль знаний. Словесные: беседа. Наглядные: таблицы, схемы. |
1 |
2.4. Учебно-материальная база организации учебного процесса.
Для проведения спецкурса „Белок – основа жизни“ необходима соответствующая учебно-материальная база, включающая основные химические реактивы, оборудование.
Также нами подобраны наглядные пособия в виде схем, таблиц, рисунков, где отражены структуры белковой молекулы, аминокислотный состав белков, фрагмент первичной структуры молекулы инсулина и др.
Кроме имеющихся в продаже нами использовались и рекомендованы пособия, которые могут быть выполнены учителем или учащимися. (Примеры некоторых таблиц, используемых при проведении занятий. См. в приложении № ).
Нами составлена таблица, в которой отражен перечень реактивов, оборудования и дополнительного материала для проведения лабораторного эксперимента.
Таблица. Перечень необходимых реактивов и оборудования для проведения лабораторно-практических работ и демонстрационного эксперимента.
|
№ п/п |
Название лабораторно - практических работ | Реактивы | Оборудование | Материал, содержащий белок |
| 1. |
„Выделение белков из тканей и биологических жидкостей“. - выделение казеина из молока; |
10 % раствор HCl; 10 % раствор NaOH; конц. HNO3; 1 % раствор CuSO4, молибденовый реактив; лакмусовая бумага, дистиллированная вода. |
Химические стаканы (V=50 мл); мерные цилиндры, стеклянные палочки и воронка; бюретка, фильтры бумажные, пробирки с обратным холодильником, штативы с пробирками, песчаные бани | Молоко |
| - получение раствора яичного альбумина; | дистиллированная вода. | химические стаканы ( 500 и 100 мл); цилиндры (500 и 250 мл); мерная колба (100 мл); воронка, стеклянная палочка с резиновым наконечником, складчатые фильтры. | белок куриного яйца | |
| - белки мяса; | 10 % раствор NaCl; | химические стаканы; стеклянная палочка; бумажный складчатый фильтр (или двойной слой марли). | обезжиренное мясо | |
| - растительные альбумины; | 100 мл дистиллированной воды | химические стаканы, центрифуга, воронка, складчатый фильтр; колбы. | пшеничная мука | |
| 2 |
„Реакция осаждения белков” - свёртывание белков при нагревании; |
1 % раствор уксусной кислоты; 10 % раствор уксусной кислоты, насыщенный раствор NaCl; | 5 пробирок, спиртовка, пипетки. | раствор белка |
| - осаждение белков концентрированными минеральными кислотами |
Концентрированные HNO3; H2SO4; HCl; |
3 пробирки; пипетки; стеклянные палочки | раствор белка | |
| -осаждение белков органическими кислотами |
5 % раствор трихлоруксусной кислоты; 20 % раствор сульфосалициловой кислоты |
2 пробирки; пипетки | раствор белка | |
| - осаждение белков солями тяжёлых металлов |
раствор CuSO4, раствор ацетата свинца |
2 пробирки; пипетки | раствор белка | |
| - осаждение белков фенолом и формалином | насыщенный водный раствор фенола, формалин | 2 пробирки; пипетки | раствор белка | |
| - осаждение белков спиртом | кристаллический NaCl | пробирка; пипетка | раствор белка | |
| 3. | „Диализ белка“ |
насыщенный раствор (NH4)2SO4; 5 % раствор BaCl2; 1% раствор CuSO4; 10 % раствор NaOH |
стаканы (100 мл); целлофан в виде квадратов 150x150 мм; стеклянные палочки; резиновые колечки; штатив с пробирками; пипетки с делениями | 3 % раствор яичного альбумина |
| 4. |
„Гидролиз белка“ - кислотный гидролиз; |
Концентрированная HCl; 10 % раствор NaOH; 1 % раствор CuSO4 |
Штатив с пробирками, круглодонная колба с воздушным холодильником; капельницы | раствор яичного белка |
| ферментативный гидролиз |
дистиллированная вода; 1 % раствор пепсина |
2 пробирки; водяная баня; колба (V=100 мл) | раствор яичного белка | |
| 5. | „Денатурация белков“ |
насыщенный раствор (NH4)2SO4; концентрированная HNO3; этиловый спирт; 1 % раствор уксусной кислоты; 10 % раствор NaOH |
6 пробирок; пипетка; спиртовка; двойной слой марли; зажим для пробирок | раствор яичного белка |
| 6. |
„Качественные реакции на белки“. - Биуретовая реакция (обнаружение в молекулах белков пептидных связей) |
30 % раствор NaOH; 1 % раствор CuSO4 |
пробирки, пипетка | раствор белка |
| - Нингидриновая реакция | 1 % раствор мингидрина в 95 % -ом растворе ацетона | пробирки, колбы, пипетка, водяная баня | раствор белка | |
| - Ксантопротеиновая реакция |
концентрированная HNO3; |
3 пробирки; пипетка; спиртовка; зажим для пробирок | раствор яичного белка, миозина, желатина | |
| - Реакция на тирозин (реакция Миллона) | реактив Миллона | 4 пробирки; пипетки, спиртовка; зажим для пробирок | раствор яичного белка, миозина, желатина, тирозина | |
| - Реакция на цистеин (реакция Фоля). | 30 % раствор NaOH; 5 % раствор ацетата свинца | 3 пробирки; пипетки; спиртовка; зажим для пробирок | раствор яичного белка, миозина, желатина | |
| - Реакция на аргинин (реакция Саканути) |
Кристаллический резорцин; 3 % раствор H2O2; концентрированная H2SO4 |
3 пробирки, пипетка, стеклянная ложечка. | раствор яичного белка, миозина, желатина | |
| - Реакция на триптофан (реакция Шульца-Распайля) |
раствор сахарозы; концентрированная H2SO4 |
пробирка, пипетка | раствор яичного белка | |
|
- Реакция на гистидин и тирозин (реакция Паули) |
1 % раствор сульфаниловой кислоты; 10 % раствор NaNO2; 10 % раствор Na2CO3 |
пробирка, пипетка, стеклянная палочка | раствор яичного белка | |
| - Реакция на триптофан (реакция Адамкевича). |
ледяная уксусная кислота; глиоксиловая кислота, концентрированная H2SO4; |
пробирки; пипетка; стеклянная палочка, спиртовка; зажим для пробирок, лёд. | неразбавленный яичный белок | |
| - Реакция Вуазене |
2,5 % раствор формальдегида, концентрированная HCl; 0,5 % раствор NaNO2 |
пробирка; пипетка; стеклянная палочка | разбавленный раствор белка | |
| - Нитропруссидная реакция |
насыщенный раствор (NH4)2SO4; 5 % раствор нитропруссида натрия; концентрированный раствор аммиака |
пробирка, пипетка, стеклянная палочка | раствор белка |
Выводы по II главе:
Впервые разработана и предложена программа спецкурса „Белок – основа жизни“.
В объяснительную записку включены цели и задачи спецкурса, а также общее количество часов отводимых на его изучение.
В рекомендованной нами рабочей программе раскрыто содержание изучаемых вопросов по десяти основным разделам.
Тематическое планирование спецкурса распределяет материал по часам с указанием форм, методов и средств обучения.
Глава III.
Апробация некоторых дидактических материалов спецкурса в лабораторных и школьных условиях.
3.1. Задачи и организация апробации.
Не претендуя на исчерпывающее решение рассматриваемой проблемы формирования у учащихся знаний о химической природе белков и особенностях белковых тел как носителей жизни, мы выделили для исследования следующие вопросы:
Разработать программу спецкурса „Белок – основа жизни“.
Отработать её содержание на основе тематического планирования.
Апробировать некоторые материалы спецкурса в лабораторных и школьных условиях.
Показать эффективность предлагаемых форм, методов и средств изучения белков на примере некоторых тем курса.
При составлении программы и разработке тематического планирования спецкурса мы поставили и реализовали следующие задачи.
Дать учащимся представление о химической природе белков.
Познакомить их с особенностями белковых тел, как носителей жизни.
Углубить, расширить и актуализировать имеющиеся у учащихся знания по химии, биологи с помощью рассмотрения теоретических вопросов, касающихся строения, способов выделения, свойств и функций белков, подтверждая их химическим экспериментом.
Познакомить с некоторыми методическими приёмами, используемыми при выделении белков из различных тканей и биологических жидкостей.
Способствовать овладению методами анализа аминокислотного состава белков с помощью цветных реакций.
Акцентировать внимание учащихся на биологической ценности белков по аминокислотному составу.
Выработать у школьников правильное отношение к своему здоровью, дать рекомендации по повышению их осведомленности в области влияния рационального питания на нормальное функционирование организма.
При отборе материала, для апробации некоторых тем спецкурса, наряду с углублением теоретических вопросов большое внимание нами уделялось демонстрационному эксперименту, практическим и лабораторным работам, благодаря которым формируется твердое убеждение в истинности научных фактов. Эксперимент проводился в естественных условиях, в нем участвовали учащиеся X, XI классов.
Введение
Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многообразными функциями в жизни организма, как белки.
Во-первых, белки обладают рядом особенностей, которые несвойственны никаким другим органическим соединениям. Эти особенности обеспечивают функционирование белковых тел как носителей жизни. К их числу относятся:
Бесконечное разнообразие структуры и вместе с тем высокая видовая специфичность её;
Способность к внутримолекулярным взаимодействиям;
Способность отвечать на внешнее воздействие закономерным изменением конфигурации молекулы;
Наличие биокаталитических свойств и ряд других качеств.
Во-вторых, наша пища – это белки, жиры, углеводы, витамины, соли, вода. Все эти компоненты жизненно важны, необходимы, у каждого свои функции в организме. Но только белки используются для построения тела организма, для создания своих собственных белковых веществ. Однако, если организму не хватаем энергии, он сжигает аминокислоты белков.
Белки являются основной составной частью протоплазмы клетки; существование живой клетки, не содержащей белковых веществ, невозможно.
Сложная совокупность явлений, которая характерно для живого организма, имеет в своей основе процессы синтеза и разложения белковых веществ. Упрощенно можно представить построение белка организмом таким образом, что из кишечника аминокислоты всасываются в кровь, которая разносит их по всем клеткам организма. В клетках аминокислоты снова синтезируются в белки, но ухе другие, необходимые именно этим клеткам. Из этой упрощенной схемы видно, насколько необходимо поступление в организм человека полноценной белковой пищи.
Актуальность нашей работы заключается в том, что в современном обществе отмечается общее ухудшение условий жизни и, в частности, питания, что приводит к голоданию большого числа людей. Особенно не дополучают необходимое количество пищи за счёт её белковых компонентов (мяса, яиц, молочных продуктов).
Разработанный нами спецкурс „Белок – основа жизни“ помогает учащимся понять важность белковых тел для процессов жизнедеятельности и необходимость полноценного питания для нормального функционирования организма.
Поэтому проблема изучения белков, особенно в вопросе замены традиционной белковой пищи другими природными продуктами с высоким содержанием белка является в настоящее время актуальной.
Целью нашего исследования из всего сказанного выше является разработка спецкурса для средне школы „Белок – основа жизни“ для углубленного изучения этой темы старшеклассниками.
Для достижения поставленной цели нами были сформулированы следующие задачи:
изучить и составить обзор литературы по обозначенной проблеме.
На основании изученной научной, научно- и учебно-методической литературы разработать рабочую программу и провести тематическое планирование спецкурса.
3.2. Формы, методы и средства обучения, используемые при изучении спецкурса.
Ознакомившись с методической литературой по организации факультативных курсов [17, 18, 39], пособиям по методике преподавания химии в средней школе [10, 11, 16, 28, 39, 53], мы пришли выводу о том, что спецкурс занимает промежуточное положение между уроками и внеурочной работой. От уроков он отличается тем, что учащиеся занимаются на спецкурсе по желанию в зависимости от своих индивидуальных запросов, интересов, но по определенной программе и расписанию.
В методической литературе по химии нет единство в определении этой формы, что по-видимому, связано с большим разнообразием различных вариантов организации спецкурса. Основная педагогическая цель спецкурса – развитие учащихся, их интересов и склонности к какой-либо науке.
Занятия на спецкурсе меньше ограничены программой, временем, чем факультативные занятия. Это позволяет значительно полнее удовлетворять индивидуальные запросы учащихся, особенно в отношении эксперимента.
На спецкурс принимаются как учащиеся с уже определившимся стойким интересом к химии, так и учащиеся, ещё не проявившие особых наклонностей к занятиям химией.
Спецкурс по химии является продолжением учебно-воспитательного процесса, начатого на уроке. Он способствует закреплению расширению и углублению знаний учащихся по данной дисциплине. Занятия на спецкурсах развивают умение самостоятельно работать с литературой и экспериментировать, воспитывают дисциплинированность, настойчивость в работе, наблюдательность, точность, аккуратность, развивают чувство взаимопомощи и коллективизма.
В.А. Сухомлинский писал: „Логика учебного процесса таит в себе опасность замкнутости и обособленности, потому что в школе на каждом шагу подчёркивается (иначе не возможно): достигай успеха собственными усилиями, не надейся на кого-то и результаты умственного труда оцениваются индивидуально. Чтобы школьная жизнь была проникнута духам коллективизма, она не должна исчерпываться уроками“.1
При выборе форм организации учебного процесса и методов работы на спецкурсе необходимо учитывать содержание спецкурса, интерес учащихся к предмету, а также уровень развития и подготовленности школьников.
Одно из главнейших требований к формам и методам обучения состоит в том, что они должны стимулировать активную работу мысли учащихся, развивать самостоятельность мышления а также способность творческой разносторонней деятельности.
Тщательный анализ литературы [10, 16, 17, 18, 19, 20, 26, 28, 30, 39, 49], позволил нам выбрать те необходимые методы, формы, средства, с помощью которых можно достигнуть выполнение поставленных задач.
Из словесных методов наиболее часть применяется нами лекция.
Лекция должна быть построена таким образам, чтобы вызвать у учащихся интерес к её содержанию, привести к поискам ответов на поставленные вопросы.
От лекций в ВУЗе школьная лекция отличается тем, что она часто превращается беседу после изложения отдельных вопросов с целью выявления понимания, материала и привлечения знаний; имеющихся у учащихся при раскрытии новых вопросов [23, 26, 30, 41]. При проведении лекций мы часто используем демонстрационный эксперимент, иллюстрирующий физические, химические свойства аминокислот и белков, а также качественные реакции на белки (Пример урока-лекции см. в приложении № ).
Семинар относится к новым в школьной практике методам. Как правило, он проводится после изучения большой темы, раздела в форме обсуждения той или иной проблемы. В ходе семинара возможно выяснение трудных для понимания и усвоения вопросов [17, 23, 26, 30]. (Пример урока-семинара см. в приложении № ). Семинарские занятия побуждают учащихся к самостоятельному изучению литературы и способствуют общению и закреплению знаний.
Из наглядно-действенных методов нами рекомендуются лабораторно-практические работы. Они проводятся непосредственно после изучения некоторых тем и касаются выделения белков из тканей и биологических жидкостей, гидролиза белка, качественных реакций на белки и др.
(Описание опытов см. в приложении № …, пример урока практической работы см. в приложении №…).
3.3. Методика апробации материалов спецкурса и определение результативности выполненной работы.
Организация апробации потребовала целенаправленного планирования. При постановке эксперимента мы руководствовались не только содержанием и структурой спецкурса „Белок – основа жизни“, но и разработали некоторые дидактические материалы к нему, а также определенные формы организации занятий. Разумеется мы основывались на тех знаниях, умениях и навыках учащихся, которые сформировались у них в течение всего времени обучения химии и биологии. При этом были поставлены цели формирования у учащихся новых умений и навыков:
Выделение в излагаемом материале главного.
Краткая запись основных положений.
Наблюдение за демонстрационным химическим экспериментом, объяснение его результатов, формулирование выводов.
Выполнение заданий предлагаемых по ходу изложения материала.
Практическое применение изучаемых вопросов в жизни.
Формирование исследовательских навыков и прочного интереса к химии.
Умение самостоятельно работать с учебными пособиями, научной литературой.
Были отобраны темы для апробации спецкурса, при этом учитывалось следующее:
материал, отобранный нами, углубляет знания, получаемые учащимся в ходе изучения химии; и вместе с тем он является принципиально новым, т.к. связан с практической направленностью данной учебной дисциплины;
материал, для апробации представляет целый курс, раскрывающий вопросы строения, свойств, открытия, функций белков, подтверждаемый результатами выполняемых лабораторно – практических работ к демонстрации химических экспериментов.
Для реализации поставленных задач нами апробированы и предложены на основании этого некоторые формы, методы и средства.
Следует при этом отметить, что мы не изобрели ничего нового, а использовали для проведения эксперимента материалы, описанные в педагогической и методической литературе. В большинстве случаев авторы делятся опытом работы, на есть и результаты по проведённым педагогическим исследованиям, подобным нашему.
Однако, как уже отмечалось, работ по исследуемой нами проблеме не имеется, поэтому нам пришлось для апробации впервые самостоятельно разрабатывать материалы, подобные описанным в литературе (но по другим темам).
Апробировано несколько тем спецкурса для учащихся X и XI классов с использованием разнообразных приёмов и методов преподавания.
Кроме этого нами проведено анкетирование, выявляющее отношение школьников по всем видам деятельности, предлагаемых при апробации спецкурса.
Вопросы анкеты 1, выявляющей отношение учащихся к спецкурсу „Белок – основа жизни“.
Нравится ли вам посещать спецкурс?
Способствовал ли спецкурс „Белок – основа жизни“ узнать новые, до этого неизвестные нам факты?
Читаете ли вы литературу по проблеме белков до посещения спецкурса?
Читаете ли вы её сейчас?
Понравилась ли вам лекционно-семинарская форма проведения занятий?
Трудно ли было вам работать с научной литературой по проблеме белков?
Интересно ли было слушать выступления одноклассников на семинарских занятиях?
Нравилось ли вам изготавливать таблицы, схемы, рисунки, модели к спецкурсу?
Нравилось ли вам выполнять лабораторно-практические работы?
Трудно ли было вам самостоятельно объяснить результаты химического эксперимента?
Как вы считаете, необходим ли демонстрационный эксперимент при проведении лекции?
Считаете ли вы необходимым проводить контрольные работы при изучении спецкурса?
Результаты ответов учащихся на вопросы анкеты представлены на графике1.
Г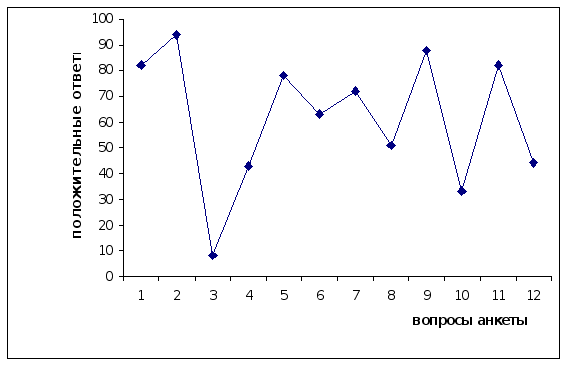
рафик
1. Ответы учащихся
на вопросы
анкеты 1 (выявляющей
отношение
учащихся к
спецкурсу
„Белок – основа
жизни“).
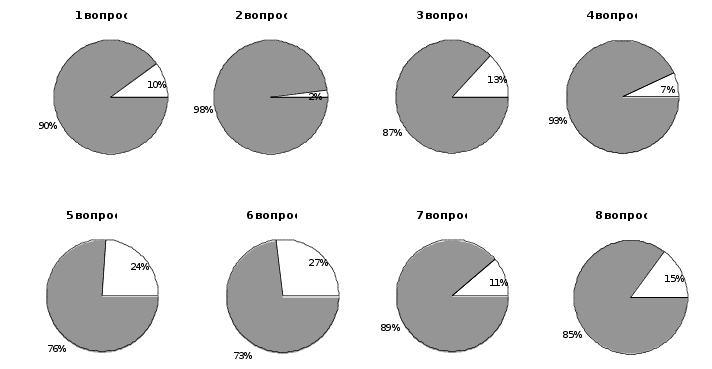
Анализ и график ответов учащихся на вопросы анкеты показал, что 83 % учащихся нравилось посещать спецкурс, причем 94 % школьников посещающих спецкурс, имели возможность узнать новые, до этого неизвестные факты.
Лишь немногие (8 %) читали литературу по проблеме белков до посещения занятий. В ходе спецкурса применялись различные формы обучения: лекции, семинарские занятия, выполнение лабораторно-практических работ. 78 % учащихся понравились лекционно-семинарские занятия, а 89 % положительно ответили на вопрос. „Нравилось ли вам выполнять лабораторно практические работы“. При подготовке к семинарам учащиеся самостоятельно работали с литературой, в том числе и научной. Но изучение научной литературы у 63 % школьников вызвало затруднения. 33 % учащихся было трудно самостоятельно объяснять результаты химического эксперимента.
При изготовлении схем, таблиц, моделей учащиеся проявили своё творчество (52 % положительных ответов). 72 % школьников во время семинарских занятий интересно было слушать выступления одноклассников. Что касается поведения контрольных работ во время спецкурса, то 43 % учащихся считают их необходимыми.
Таким образом, результаты анкеты № 1, представленные на графике 1, показали, в основном, положительное отношение учащихся к содержанию спецкурса, а также к формам, методам и средствам используемым при его преподавании.
3.4. Показатели результативности проведённой работы.
Целью и критерием результативности работы являлось оптимальное усвоение учащимися тех знаний, которые предлагались на занятиях спецкурса.
При сравнительном изучении методов и приёмов, было сочтено необходимым принять за основу критерии, которые оправдали себя в практике общеобразовательной школы.
В качестве показателей эффективности явились результаты письменного и устного опросов, прямого и косвенного наблюдений, сравнений.
Опрос проводился в виде анкетирования, контрольных работ, тестирования. Проанализировав ответы учащихся на вопросы анкеты, мы вывели процентное соотношение числа правильных ответов школьников к общему числу опрошенных. На основании полученных данных были построены графики и диаграммы. Анкетирование выявило информированность учащихся о белках до посещения ими спецкурса и после него.
Вопросы анкеты 2,
выявляющие информированность учащихся о белках до посещения спецкурса.
Что такое белки?
Из чего они состоят?
В каких продуктах питания они содержатся в наибольшем количестве?
Какую роль выполняют белки в организме человека?
Как получают белки?
Можно ли синтезировать белки в промышленных условиях?
Ответы учащихся анализировались, результаты анализов представлены в таблицах…
Таблица 1. Ответы учащихся на вопросы анкеты 2 (до посещения спецкурса).
| Вариант ответа | № вопроса | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
|
Правильный ответ |
33% | 16% | 44% | 36% | 12% | 7% |
|
Правильный, но неполный ответ |
24% | 64% | 48% | 32% | 6% | 8% |
|
Ответ, содержащий много ошибок |
28% | 12% | 6% | 21% | 54% | 33% |
|
Неправильный ответ или полное его отсутствие |
15% | 8% | 2% | 11% | 28% | 52% |
Исходя из данных таблицы видно, что необходимость введения предлагаемого спецкурса в школьных условиях обусловлена:
Малой информированностью школьников по обозначенной проблеме.
Важностью предлагаемого материала для правильного понимания жизненных процессов.
Формированием новых представлений о химической природе белка в дополнение к тем знаниям, которые учащиеся получили на уроках биологии.
Развитием устойчивого интереса к химии.
Таблица 2. Ответы учащихся на вопросы (после посещения спецкурса).
| Вариант ответа | № вопроса | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
|
Правильный ответ |
90% | 95% | 75% | 87% | 64% | 63% |
|
Правильный, но неполный ответ |
10% | 5% | 23% | 9% | 17% | 25% |
|
Ответ, содержащий много ошибок |
- | - | 2% | 4% | 13% | 8% |
|
Неправильный ответ или полное его отсутствие |
- | - | - | - | 6% | 4% |
Диаграмма 1. Правильные ответы учащихся на вопросы анкеты 2 до посещения ими спецкурса и после него.
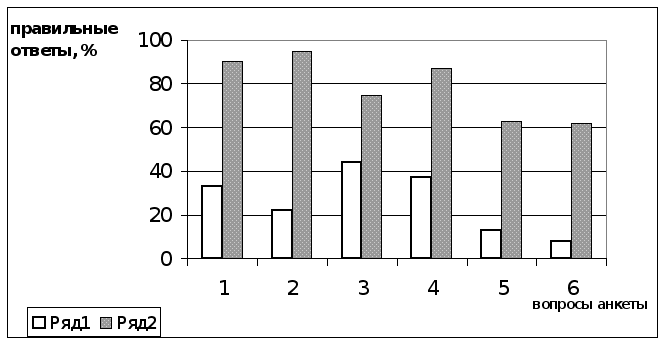
Ряд 1 – результаты до и Ряд 2 – после эксперимента.
Вывод по таблицам:
Анализ результатов анкеты 2, представленных в таблице …и на диаграмме 1, показал, что наибольший прирост знаний составил по 2-му вопросу. На диаграмме 1 наглядно видно, что начальные знания наименьшими были по 2,5 и 6 вопросам. Но после посещения спецкурса именно по этим вопросам анкеты информированность учащихся резко повысилась (95, 64, 63).
Для определения эффективности применяемых форм, методов и средств обучения использовались результаты контрольной работы и тестирования по 2-м вариантам.
Контрольная работа и тестирование проводились после изучения некоторых тем спецкурса. Результаты контрольной работы отражены на столбчатой диаграмме 2, результаты тестирования не круговых диаграммах.
Контрольная работа.
Вариант I.
Что такое белки? Дайте определение.
Перечислите основные химические элементы, входящие в состав белков.
Выберите из таблицы № … три аминокислоты и составьте формулы всех образуемых ими трипептидов.
Как объяснить большое многообразие белков в природе?
Как в лабораторных условиях можно осадить белок?
Напишите формулы веществ, образующихся при гидролизе соединения:
…
Используя таблицу № … назовите эти вещества.
Вариант II.
Напишите общую формулу белка. Выделите связь характерную для молекулы белков.
Где белки встречаются в природе? Каково их значение?
Напишите структурные формулы пептидов:
а) цис – тир;
б) ала – глу – вал.
Какой реакцией можно доказать наличие белка, в том или ином продукте питания?
Какие явления происходят с белком:
а) при нагревании;
б) при добавлении формальдегида.
Напишите формулы веществ, образующихся при гидролизе соединения:
…
Используя таблицу № … назовите эти вещества.
Д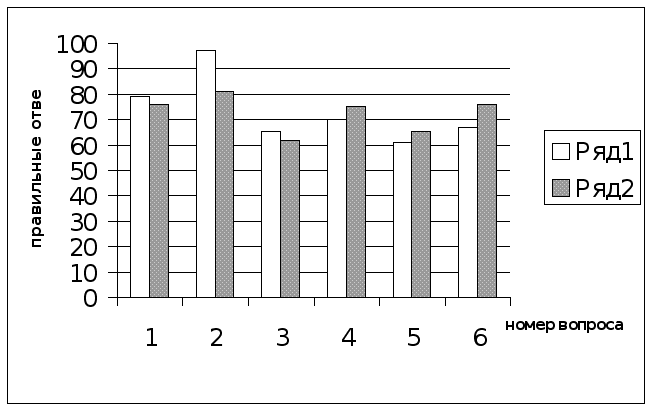
иаграмма
2. Ответы учащихся
на вопросы
контрольной
работы по I
и II
вариантам.
Обозначения: Ряд 1 – ответы учащихся I варианта;
Ряд 2 – ответы учащихся II варианта.
Выводы по результатам контрольной работы.
Анализ результатов контрольной работы по двум вариантам, представленный на диаграмме № 2 доказывает, что предложенные нами формы и методы обучения тем спецкурса являются эффективными. Число правильных ответов учащихся по обоим вариантам в процентном отношении составляет больше 50 %.
Так по первому варианту число правильных ответов варьирует от 62 % до 88 %, а по второму варианту от 63 % до 80 %.
Тестирование.
Вопросы теста для первого варианта.
Первый белок (клейковина) был выделен:
а) в 1728 году Я. Беккари;
б) в 1839 году Г. Мульдером;
в) в 1899 году Э. Фишером.
При гидролизе белка образуются:
а) нуклеиновые кислоты;
б) моносахариды;
в) аминокислоты.
Первичная структура белка – это:
а) последовательность, в которой соединены остатки различных - аминокислот;
б) взаимное пространственное расположение субъединиц в единой белковой молекуле;
в) обусловлена внутри- и межмолекулярными водородными связями.
Какая связь имеется между остатками аминокислот в молекулах белков:
а)
б)
в)
Биуретовая реакция доказывает наличие в белках:
а) аминогрупп;
б) пептидной связи;
в) остатка аминокислоты аргинина.
Ксантопротеиновая реакция доказывает наличие в белках:
а) аминогрупп;
б) остатков циклических аминокислот;
в) пептидной связи.
Дыхательную функцию в организме выполняет белок:
а) - глобулин;
б) интерферон;
в) гемоглобин.
Незаменимые аминокислоты:
а) синтезируются в организме человека и животных;
б) не синтезируются в организме человека и животных, а поступают в готовом виде с пищей;
в) образуются из углеводов.
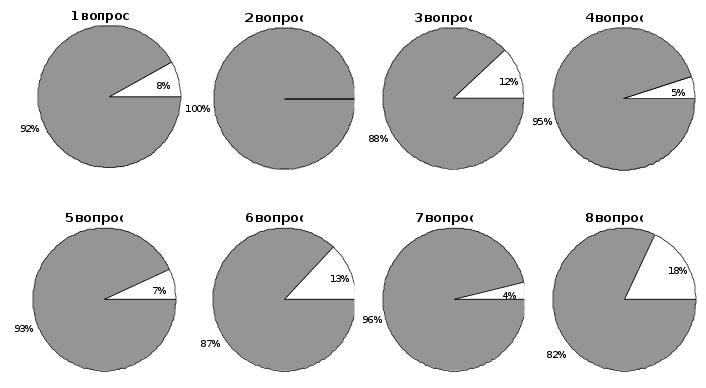
Диаграмма № 3. Ответы на вопросы теста (I вариант).
Обозначения:
п
 оложительные
ответы;
оложительные
ответы;отрицательные ответы.
Вопросы теста для II варианта:
Первый дипептид был синтезирован:
а) А. Браконно;
б) Э. Фишером;
в) Н. Зелинским;
Белок молока называется:
а) фибрин;
б) альбумин;
в) казеин.
Вторичная структура белка – это:
а) последовательность, в которой соединены остатки различных - аминокислот;
б) взаимное пространственное расположение субъединиц в единой белковой молекуле;
в) обусловлена внутри- и межмолекулярными водородными связями.
В организме человека происходит следующий гидролиз белка:
а) щелочной;
б) ферментативный;
в) кислотный.
Нингидриновая реакция доказывает наличие в белках:
а) аминогрупп;
б) пептидной связи;
в) аргинина.
Реакция Сакагучи доказывает наличие в белках:
а) остатка аминокислоты аргенина;
б) аминогрупп;
в) пептидной связи.
Защитную функцию в организме человека выполняет белок:
а) миозин;
б) гемоглобин;
в) - глобулин.
При расщеплении 1 г белка освобождается:
а) 38,9 кДж энергии;
б) 17 кДж энергии;
в) 16,1 кДж энергии.
Диаграмма № 4. Ответы на вопросы теста (II вариант).
Обозначения:
п
 оложительные
ответы;
оложительные
ответы;отрицательные ответы.
Анализируя результаты тестирования, проведенного по двум вариантам, следует отметить, что несмотря на сложность материала предполагаемого для изучения школьникам, он воспринимается ими успешно. Об этом говорят данные, наглядно представленные на диаграммах №№ 3-4.
Число отрицательных ответов по восьми вопросам теста № 1 колеблется от 4 % до 18 %. Наибольшее затруднение вызвал вопрос о незаменимых аминокислотах.
Число же отрицательных ответов по второму тесту изменяется от 2 % до 27 %. Однако, как видно из диаграмм №№ 3-4 число правильных ответов по тестам 1-го и 2-го вариантов от 82 % до 95 % (I вариант) и от 73 % до 98 % (II вариант).
Это доказывает доступность для изучения предлагаемого содержания спецкурса, а отобранный материал может быть рекомендован для изучения в условиях средней школы.
Выводы по III главе.
В третьей главе описаны и предложены формы, методы и средства, которые были использованы нами при апробации спецкурса.
В качестве показателей эффективности проведенного исследования нами были избраны:
анкетирование;
контрольные работы;
тестирование.
Вопросы анкет, содержание контрольных работ и тестов были в первые разработаны нами и предложены учащимся.
Анализ результатов ответов учащихся на вопросы анкет, контрольных работ и тестов показал высокую эффективность освоения материалов спецкурса, а для наглядности полученных результатов апробации нами были использованы таблицы, графики, диаграммы.
Выводы.
Анализ литературы показал, что проблема изучения белков является актуальной, но до нашей работы подобных исследований в школьных условиях не проводилось.
Нами впервые разработан спецкурс для средней школы „Белок – основа жизни“ рассчитанный на 30 часов. Содержание спецкурса отражено в рабочей программе, проведено планирование по темам.
Проведена апробация предлагаемого для изучения материала с применением выбранных нами форм, методов и средств, а в качестве показателей эффективности проведенного исследования были предложены:
анкетирование;
контрольные работы;
тестирование.
Анализ результатов ответов учащихся показал высокую эффективность усвоения содержания спецкурса. Однако было бы интересным и необходимым продолжить работу в направлении начатых педагогических исследований в области модульного обучения, применение компьютерных разработок и др. при изучении белков.
Заключение
В научной литературе имеется много сведений о белках, они хорошо изучены, но в методической литературе и школьной практике им уделяется недостаточное внимание.
Чтобы восполнить пробелы в знаниях школьников о белках, как веществах обладающих многообразными функциями в жизнедеятельности организмов и, в частности, построении тела организма, а также как необходимого компонента жизни, на наш взгляд необходимо ввести спецкурс „Белок – основа жизни“.
Этому посвящено наше исследование. Проведённая нами работа показывает высокую эффективность усвоения содержания спецкурса старшеклассниками и вызывает у них интерес к этой проблеме. В конечном итоге это способствует пониманию жизненных процессов, выработке правильного отношения к своему здоровью и экологии человека в целом.
1 Сухомлинский В.А. О воспитании. М., 1973.
Приложение № …
Описание некоторых лабораторно-практических работ, используемых при апробации спецкурса „Белок – основа жизни“.
Выделение белков из тканей и биологических жидкостей.
Цель: выявить содержание белков в тканях и биологических жидкостях.
Выделение казеина из молока.
Вариант I.
В химический стакан вместимостью 50 мл отмеривают цилиндром 3 мл молока и добавляют 7 мл дистиллированной воды. Смесь перемешивают и добавляют 10-15 капель 1%-ного раствора соляной кислоты. Кислоту приливают аккуратно, по каплям, так как в избытке кислоты осадок растворяется. Суспензию перемешивают, через 3-5 минут образуется рыхлый осадок.
Для удаления соляной кислоты в стакан добавляют 10 мл дистиллированной воды, перемешивают и оставляют ещё на 5 минут. Жидкость осторожно сливают с осадка. К осадку ещё раз добавляют 10 мл дистиллированной воды, осторожно перемешивают содержимое стакана и через 5 минут фильтруют смесь через бумажный фильтр.
Доказательством того, что в состав казеина входит фосфор: осадок с фильтром переносят в широкую пробирку с обратным холодильником и добавляют 6 мл 10%-ного раствора гидроксида натрия. Пробирку нагревают на песчаной бане в течение 1 часа. Жидкости дают остыть и нейтрализуют её концентрированной азотной кислотой до слабокислой реакции на лакмус. При нейтрализации выпадает осадок высокомолекулярных продуктов неполного гидролиза белка.
После отстаивания жидкость фильтруют и с фильтратом проделывают биуретовую реакцию и молибденовую пробу на фосфорную кислоту. К 5 каплям гидролизата добавляют 10%-ый раствор NaOH и 2 капли 1%-ого раствора CuSO4. Наблюдается фиолетовое окрашивание. К 10 каплям молибденового реактива добавляют 5 капель гидролизата и кипятят несколько минут. В присутствии H3PO4 жидкость окрашивается в лимонно-жёлтый цвет. При охлаждении выпадает жёлтый кристаллический осадок комплексного соединения (NH4)3PO412MoO3.
Вариант II.
К 50-ти мл свежего молока добавляют равный объём насыщенного раствора сульфата аммония. При этом выпадают в осадок альбумины и казеин. Отфильтровывают через складчатый бумажный фильтр раствор альбуминов.
Получение раствора яичного альбумина.
Осторожно проделывают отверстие в скорлупе яйца с двух концов и выливают белок в стакан вместимостью 500 мл. В тот же стакан добавляют 250 мл дистиллированной воды и содержимое стакана тщательно перемешивают стеклянной палочкой с резиновым наконечником.
Затем раствор переносят в мерный цилиндр, и объём раствора доводят до 300 мл добавлением дистиллированной воды. Раствор оставляют на 30 минут при комнатной температуре для образования хлопьевидного осадка глобулинов, затем разливают в пробирки по 20 мл.
20 мл полученной суспензии дважды фильтруют через складчатый фильтр. Фильтрат, содержащий яичный альбумин, используют для дальнейшей работы.
Выделение белков мяса.
Помещают в стакан 40-50 г пропущенного через мясорубку обезжиренного мяса, добавляют 80-100 мл 10%-го раствора NaCl и оставляют смесь стоять 15-20 минут при частом помешивании. Отфильтровывают через бумажный складчатый фильтр или через двойной слой марли окрашенную в красный цвет жидкость. В растворе содержатся главным образом, мышечный альбумин и глобулин.
Выделение растительных альбуминов.
25 грамм пшеничной муки смешивают со 100 мл дистиллированной воды, и смесь стряхивают в течение одного часа с помощью встряхивателя. Взвесь муки центрифугируют и надосадочную жидкость фильтруют через складчатый фильтр. Отфильтрованный прозрачный раствор содержит преимущественно альбумин пшеничных зёрен.
Реакции осаждения белков.
Цель: выявить влияние различных органических и неорганических веществ на осаждение белков. Изучить физические свойства белков.
Осаждение белков концентрированными минеральными кислотами.
В три сухие пробирки наливают по 1-2 мл концентрированной HNO3, H2SO4, HCl. Затем, наклонив каждую пробирку, осторожно по стенке добавляют из пипетки по 0,5 мл исследуемого раствора белка, так чтобы он не смешивался с кислотой. Вместе соприкосновения двух жидкостей появляется белый аморфный осадок белка. При встряхивании осадок, выпавший при действии HNO3, увеличивается, а осадки выпавшие при действии HCl и H2SO4, растворяются в их избытке.
Концентрированные минеральные кислоты вызывают необратимые осаждения белков. Это связано как с дегидратацией белковых молекул, так и с денатурацией белка.
Осаждение белков органическими кислотами.
В две пробирки добавляют по 2-3 мл раствора белка и добавляют в одну из них несколько капель 5%-го раствора трихлоруксусной кислоты (ТХУ), а в другую – несколько капель 20%-го раствора сульфосалициловой кислоты. В обоих случаях наблюдается выпадение осадка белка. Сульфосалициловая и ТХУ кислоты являются чувствительными и специфическими реактивами на белок.
ТХУ кислота осаждает только белки и не осаждает продукты распада белка и аминокислоты, поэтому ею пользуются часто для полного удаления белков из биологических жидкостей (например, сыворотки крови).
Осаждение белков солями тяжелых металлов.
В две пробирки добавляют по 1-1,5 мл исследуемого пастора белка, по каплям при встряхивании, добавляют в одну из них раствор CuSO4, а другую –
Pb(CH3COO)2. Выпадает хлопьевидный осадок вследствие образования малорастворимого солеобразного соединения (с солью меди – голубого цвета). При избытке реактива осадок снова растворяется.
Соли тяжелых металлов (Hg, Ag, Cu, Pb и др.) вызывают необратимое осаждение белков, образуя с ними нерастворимые в воде соединения. Потому что белки применяют в качестве противоядия при отравлении, например, ртутными солями (сулема).
- Гидролиз белка.
Цель: дать учащимся представление о кислотном, щелочном и ферментативном гидролизе белка. Опытным путём установить продукты распада белковой молекулы.
Кислотный гидролиз простого белка.
При гидролизе белки распадаются сначала на высокомолекулярные продукты – пептоны, затем на полипептиды и, наконец, на аминокислоты.
Для гидролиза отмеривают в круглодонную колбу 20 мл раствора яичного белка и 5 мл концентрированной HCl. Колбу закрывают пробкой с длинной стеклянной трубкой. Кипятят содержимое колбы под тягой в течение 45 или 90 минут.
Открытие промежуточных продуктов распада белка в гидролизате при помощи биуретовой реакции. Промежуточные продукты распада белка – пептоны – при проведении биуретовой реакции дают розовое или красное окрашивание, а белки – сине-фиолетовое.
Ферментативный гидролиз белка.
Подготовительный этап: белок куринового яйца развести 1:1 водой и раствор белка влить в кипящую воду (V=100 мл) при помешивании.
В две пробирки налить по 2 мл приготовленного раствора белка. В первую добавить 1 мл дистиллированной воды, во вторую – 1 мл 1%-го раствора пепсина. Обе пробирки поставить в водяную баню при t=37-40 0C на 15 минут. Проделать биуретовую реакцию с содержимым обеих пробирок.
В воде окраска более интенсивная (фиолетовая с синим оттенком), так как при гидролизе осталось больше пептидных связей, чем в случае с пепсином (окраска менее интенсивная – фиолетовая с розовым оттенком) – меньше пептидных связей.
В присутствии пепсина гидролиз идёт интенсивнее, чем в присутствии воды.
- Денатурация белков.
Цель: определить факторы, вызывающие денатурацию белка.
4.1. В три пробирки наливают по два мл раствора белка куриного яйца, предварительно разведённого 1:20 и профильтрованного через двойной слой марли.
В первую пробирку наливают насыщенный раствор сульфата аммония; во вторую – концентрированную HNO3; в третью – этиловый спирт. Белок свёртывается во всех пробирках.
4.2. В три пробирки добавляют по 2 мл раствора белка. Во вторую добавляют одну каплю 1%-го раствора уксусной кислоты; в третью – одну каплю 10%-го раствора NaOH. Все три пробирки нагревают над пламенем спиртовки.
В первой пробирке (pH=7) образуется осадок белка, вследствие его денатурации при нагревании, во второй пробирке осадок образуется быстрее и полнее вследствие нейтрализации белка в слабокислой среде; в третьей пробирке (pH>7) осадка не образуется даже при кипячении.
- Качественные реакции на белки.
(Цветные реакции на белки; определение аминокислотного состава белков).
Цель: Путем качественных реакций определить наличие пептидных связей и NH2 – групп в молекулах белков; выявить аминокислотный состав белков.
Обнаружение в молекулах белков пептидных связей (биуретовая реакция).
К 1-2 мл разбавленного белка добавляют двойной объем 30%-ного раствора NaOH хорошо перемешивают и приливают 2-3 капли 1%-ного раствора CuSO4. Снова тщательно перемешивают. Развивается красно-фиолетовое окрашивание. (Химизм реакции см. на стр.…).
Нингидриновая реакция.
К 2-3 мл разбавленного раствора белка приливают 3-4 капли 1%-ного раствора нингидрина в 95%-ном растворе ацетона. Раствор перемешивают и ставят в водяную баню при t=70 0С на несколько минут. Развивается сине-фиолетовое или розово-фиолетовое окрашивание.
Нингидриновая реакция доказывает наличие NH2 – групп в белках (химизм реакции на стр.…).
Ксантопротеиновая реакция (реакция на ароматические аминокислоты: фенилаланин, тирозин, триктофан).
В одну пробирку добавляют 5 капель раствора яичного белка, во вторую – раствора желатина, в третью – раствора миозина. Во все пробирки приливают по 3-5 капель концентрированной HNO3 и нагревают. В первой и третьей пробирках образовался белый осадок, который при нагревании окрашивается в желтый цвет и постепенно растворяется в (происходит гидролиз белка), сообщая желтую окраску раствору. Желатина, не содержащая ароматических аминокислот, не дает ксантопротеиновой пробы. Образование желтых пятен на коже при попадании концентрированной HNO3 обусловлено этой реакцией (химизм реакции на стр.…).
Реакция на тирозин (реакция Миллона).
Реакция обусловлена наличием в белках аминокислоты тирозина. При нагревании или продолжительном стоянии раствора белка с реактивом Миллона (раствор нитратов ртути (I) и (II) в HNO3 с примесью HNO2) образуется осадок, окрашенный сначала в розовый, а затем в кроваво-красный цвет.
В 4 пробирки наливают по 5 капель: в первую – раствора яичного белка, во вторую – раствора желатина; в третью – раствора миозина; в четвертую – раствора тирозина. Во все 4 пробирки добавляют по 2-3 капли реактива Миллона и осторожно нагревают. Наблюдают происходящие изменения (химизм реакции на стр.…).
Реакция на цистеин (реакция Фоме).
В первую пробирку приливают 5 капель 1%-ного раствора яичного белка, во вторую – 1%-ного раствора желатины, в третью – раствора миозина. В каждую пробирку добавляют по 5 капель 30%-ного раствора NaOH и по 1 капли 5%-ного раствора ацетата свинца. При интенсивном кипячении жидкость в пробирках с яичным белком и миозином темнеет, так как образуется черный осадок сульфида свинца. В пробирке с раствором желатина черного осадка не образуется, так как данное вещество не содержит серосодержащих аминокислот (химизм реакции на стр.…).
Реакция на аргинин (реакция Сакагути).
В первую пробирку приливают 5 капель раствора яичного белка, во вторую – раствора желатина, в третью раствора миозина. Во все пробирки добавляют несколько кристаллов резорцина, 1 мл 3%-ного раствора H2O2 и осторожно по стенке приливают 1 мл концентрированной серной кислоты. Через некоторое время на границе раздела (белок – кислота) развивается оранжевое окрашивание (химизм реакции см. на стр.…).
Реакция на триптофан (реакция Шульце-Распайля).
В пробирку с раствором белка приливают 2 капли раствора сахарозы и 1 мл концентрированной серной кислоты, следя, чтобы жидкости не смешивались. На границе раздела жидкостей появляется вишнево-красное окрашивание.
Суть: под влиянием серной кислоты происходит гидролиз сахарозы до моносахаридов, которые обезвоживаются, превращаясь в оксиметилфурфурол.
Реакция на гиспеидин и тирозин (реакция Паули).
В пробирку с раствором белка приливают 1 мл 1%-ного раствора сульфаниловой кислоты, 2 мл NaNO2, переливают и добавляют 2-4 мл 10%-ного раствора Na2CO3.
После смешивания раствор окрашивается в вишнёво-красный цвет (химизм реакции см. на стр.…).
Приложение № …
Конспект урока – лекции.
Тема: „Химический состав организмов. Общее знакомство с белками“.
Цель: изучить химический состав организмов. Определить значение белков в осуществлении процессов жизнедеятельности, выявить особенности функционирования белковых тел как носителей жизни.
Задачи:
Образовательные: познакомить учащихся с химическим составом организмов: макроэлементы, микроэлементы, ультраэлементы. Определить место белков в жизненных процессах, выявить их значение и особенности функционирования как носителей жизни. Изучить элементный состав белков.
Развивающие: довести до сознания учащихся необходимость изучения белковых тел. Развить понятие „белок“. Формирование интеллекта, мышления учащихся, правильного понимания жизненных процессов.
Воспитательные: воспитание научного мировоззрения; эстетическое, экологическое, нравственное воспитание.
Тип урока: изучение нового материала.
Методы:
словесные (лекция);
наглядные (демонстрация таблиц „Элементарный состав белков“, „Первичная структура молекулы инсулина быка“, „Аминокислоты, постоянно встречающиеся в составе белков“, демонстрация модели белка гемоглобина).
Структура урока:
Вводная часть.
подготовка учащихся к уроку;
подготовка к восприятию нового материала.
Изучение нового материала.
изучение нового материала;
запись выводов в тетрадь.
Заключительная часть.
выявление понимания изученного материала;
домашнее задание.
План урока:
Химический состав организмов.
Значимость проблемы изучения белков.
Особенности белковых тел как носителей жизни.
Общее знакомство с белками.
Ход урока:
Водная часть.
подготовка учащихся к уроку;
сообщение темы и цели урока.
Изучение нового материала.
Химический состав организмов.
Вопрос учащимся:
Как вы считаете, какие химические элементы входят в состав живых организмов?
Какие из них встречаются в наибольшем количестве?
В организмах, составляющих биомассу Земли, обнаружено свыше 60 химических элементов. Среди них имеется группа элементов, постоянно встречающихся в составе любого организма, независимо от систематической принадлежности и уровня организации последнего. К их числу относятся: C, N, H, O, S, P, K, Ca, Mg, Zn, Fe, Mn, Cu, и Co. Остальные элементы, обнаруженные в биомассе, принадлежат к категории иногда встречающихся; их присутствие характерно лишь для некоторых групп организмов. Наиболее распространенными из них являются Mo, B, V, Na, J, Cl и некоторые другие.
По количественному содержанию в живом веществе элементы делят на три категории: макроэлементы, концентрация которых превышает 0,001% (O, C, H, Ca, K, N, P, S, Mg, Na, Cl и Fe), микроэлементы, доля которых составляет от 0,001% до 0,00001% (Mg, Zn, Cu, B, Mo, Co, и многие другие), и ультраэлементы, содержание которых не превышает 0,000001% (Hg, Au, U, Ra, и др.).
Многочисленные макро- и микроэлементы, образующие живую материю, присутствуют в ней в виде разнообразных химических соединений.
Примерно 75% биомассы составляет вода. Вода играет огромную роль в создании условий для жизнедеятельности. Она образует ту среду, в которой протекают физико-химические процесс, обеспечивающие постоянное возобновление живого вещества. Вторым по количественному содержанию в биологических объектах, но, несомненно, первым и главным по значению классом соединений являются белки. В среднем можно принять, в сухом веществе организмов содержится 40-50% белка, причем растительному миру свойственно отклонение от этой средней величины в сторону понижения, а животному – повышения. Микроорганизмы обычно богаче белком (некоторые же вирусы являются почти чистыми белками). Таким образом, в среднем можно принять, что 10% биомассы на Земле представлено белком, то есть его количество измеряется величиной порядка 1012 - 1013 тонн. Остальные 50% сухого вещества организмов составлены соединениями других классов. Это – углеводы, ликиды и минеральные вещества, содержание которых в организмах сильно варьирует.
Значимость проблемы изучения белков.
В природе насчитывается 1012 разных белков. Они обеспечивают жизнь более 2 млн. видам организмов.
Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многогранными функциями в жизни организма как белки.
Ф. Энгельс писал: „Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом и повсюду, где мы встречаем какое-либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явления жизни“.
Почему именно белки являются материальным субстратом жизни?
Потому, что они обладают рядом особенностей, которые несвойственны никаким другим органическим соединениям.
Особенности белковых тел как носителей жизни.
бесконечное разнообразие структуры и вместе с тем высокая видовая специфичность её;
крайнее многообразие физических и химических превращений;
способность к внутримолекулярным взаимодействиям;
способность отвечать на внешнее воздействие закономерным изменением конфигурации молекулы.
Склонность к взаимодействию с другими химическими соединениями с образованием надмолекулярных комплексов и структур;
Наличие биокаталитических свойств и ряд других качеств.
Только детально изучив строение белков и их свойства, можно понять как указанные особенности белков, так и их функции.
Общее знакомство с белками.
Белки – это высокомолекулярные азотсодержащие органические соединения, полифункциональные амфотерные электролиты, молекулы которых состоят из остатков аминокислот.
Элементный состав белков:
C – 50 – 55%; H – 7 – 8%;
O – 21 – 25%; S – 1 – 2%;
N – 16%; P – менее 1%.
Особенно характерный показатель – процентное содержание азота. В большинстве случаев оно составляет 16%, поэтому по содержанию белкового азота часто вычисляют содержание белка в кормах и продуктах питания. Для этого величину, выражающую процентное содержание белкового азота в препарате, умножают на фактор пересчета, равный 6,25, который выводят путем деления: 100:16 = 6,25.
Белки кроме основных химических элементов включают и другие химические элементы. Например, гемоглобин содержит железо, ферменты – оксидазы содержат медь, ДНК-аза – кальций; РНК-аза – магний и др.
Молекула белка состоит из одной или нескольких полипептидных цепей, которые состоят из большого числа остатков аминокислот (протеиногенных кислот). В природе насчитывается свыше 200 различных аминокислот. Из них только 20 – белковые (18 аминокислот + 2 амида: аспарагин и глутамин).
Общая формула белка:
![]()
![]() O O
O O
|| ||
NH2 – CH – C – N – CH – C – N – CH – COOH
| | | | |
R H R H R
n
Опорный конспект
60 химических элементов
![]()
ОРГАНИЗМ(микро – растительный, животный) |

![]()

Макро - Микро - Ультра –
Э Л Е М Е Н Т Ы
Л Е М Е Н Т Ы
O, C, H, Ca, K, N, Mn, Zn, Cu, B, Hg, Au, U, Ra и др.
P, S, Mg, Na Mo, Co, и др.
| Сухое вещество организмов |


40 – 50% остальные 50%
белки углеводы, липиды, минеральные вещества
в![]()
![]() природе 1012
в одной
клетке до 3000
природе 1012
в одной
клетке до 3000
|
|
C, O, N, H, S, P 18 а.к + 2 амида
![]() +
20
+
20
другие химические
элементы
(Pe, Cu, Mg, Ca, и др.).
III Заключительная часть
запись опорного конспекта в тетрадь;
домашнее задание: записи в тетрадях, подготовка к семинарскому занятию.
Литература для подготовки к семинарскому занятию:
Андреева Е.В. Химия жизни. – Л.: Детская литература, 1967.
Асатиани В.С. Химия нашего организма. – М.: Наука, 1969.
Макаров К.А. Химия и здоровье: Книга для внеклассного чтения учащихся 8 – 10 классов средней школы. – М.: Просвещение, 1985.
Шамин А.Н. История биологической химии. – М.: Наука, 1994.
Шульпин Г.Б. Химия для всех. – М.: Знание, 1987.
Приложение №…
Конспект лабораторно – практической работы „Выделение белков из тканей биологических жидкостей“.
Цель: формирование практических умений, совершенствование знаний полученных при изучении темы „Методы выделения белков“.
Задачи:
Образовательные: углубить, расширить и систематизировать знания учащихся опираясь на основные понятия темы. Дать работу по вариантам. Четко сформулировать вопросы. Познакомить учащихся с техникой выполнения работы. Дать рекомендации по её выполнению.
Развивающие: познакомить учащихся с некоторыми методическими приемами, используемыми при выделении белков из тканей и биологических жидкостей. Сформулировать практические умения работы с химическим оборудованием, химическими реактивами и биологическими объектами. Развитие интеллекта, мышления учащихся, развитие умения делать выводы на основе полученных результатов.
Воспитательные: воспитание научного мировоззрения на основе выполненной работы сделанных выводов, эстетическое, экологическое и нравственное воспитание.
Тип урока: совершенствование знаний.
Методы:
словесные (рассказ, беседа);
наглядные (демонстрация таблиц);
наглядно – действенные (выполнение лабораторно – практической работы).
Оборудование: цилиндры, химические стаканы на 50 и 500 мл, пробирки, стеклянные палочки с резиновыми наконечниками, складчатые фильтры, марли, обратный холодильник.
Реактивы: 1% раствор HCl; концентрированная азотная кислота; 10% раствор NaOH; 1% раствор сульфида меди; насыщенный раствор (NH4)2SO4; дистиллированная вода; 10% раствор NaCl.
Материал, содержащий белок: молоко, куриное яйцо, обезжиренное мясо, пшеничная мука.
Структура урока:
Вводная часть.
Главная часть.
Заключительная часть.
Подготовительный этап: работа проводится по группам (всего три группы). За урок до лабораторно-практического задания учитель делит класс на группы, определяет тему лабораторно-практической работы для каждой группы и раздает карточки – инструкции для ознакомления учащихся с ходом работы.
Предварительно учитель и лаборант готовит необходимые реактивы и оборудование.
Ход урока:
Вводная часть.
подготовка учащихся к уроку;
выяснение техники проведения эксперимента у каждой группы (последовательность выполнения действий, ожидаемый результат, техника безопасности).
Главная часть.
выполнение лабораторно-практической работы:
I вариант (группа) - „Выделение казеина из молока“.
II вариант (группа) - „Получение раствора яичного альбумина“, „Выделение растительных альбуминов“.
III вариант (группа) - „Выделение белков мяса“.
(Описание лабораторно-практических работ см. в приложении №…).
Учитель следит за ходом выполнения работы каждой группы, подсказывает, замечает ошибки.
- Заключительная часть.
краткая запись хода работы;
формулирование выводов;
учитель отмечает положительные и отрицательные моменты выполнения работы.